
【题目】高纯度晶硅是典型的无机非金属材料,又称“半导体”材料.它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备:

下列说法不正确的是
A. 步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 步骤①中每生成1mol Si,转移4mol电子
C. 高纯硅是制造太阳能电池的常用材料,二氧化硅是制造光导纤维的基本原料
D. SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1mol金属钠与氧气完全反应,转移的电子数一定为NA
B. 25℃时,pH=1盐酸溶液中含有H+的数目约为0.1NA
C. 任意条件下,1mol苯中含C-C键的数目一定为3NA
D. 密闭容器中充入1molNO2,气体分子数一定是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 在冰(固态水)中,既有极性键、非极性键、又有氢键
B. 二氧化碳分子是由极性鍵形成的非极性分子
C. 含有金属阳离子的晶体一定是离子晶体
D. 金属晶体的熔沸点一定比分子晶体的高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2012年4月15日,央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊进入患者腹中。明胶是水溶性蛋白质混合物,溶于水形成胶体。由工业明胶制成的胶囊往往含有超标的重金属Cr,从而对人体造成伤害。
①已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是______价。CrO2-是一种酸根离子,则Fe(CrO2)2属于______(填“酸”、“碱”、“盐”或“氧化物”)。
②明胶的水溶液和K2SO4溶液共同具备的性质是______。
a.都不稳定,密封放置沉淀 b.两者均有丁达尔现象 c.分散质微粒可通过滤纸
(2)已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
①MnO2和HSCN的浓溶液共热的化学方程式______。
②(CN)2和NaOH 溶液反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2molA与2molB混合于2L的密闭容器中,发生如下反应,2A(g)+3B(g) ![]() 2C(g)+2D(g),2s后A的转化率为50%,测得v(D)=0.25mol/(L·s)。下列推断不正确的是
2C(g)+2D(g),2s后A的转化率为50%,测得v(D)=0.25mol/(L·s)。下列推断不正确的是
A. z=2
B. 2s后,容器内的压强是初始的7/8倍
C. 2s时,C的体积分数为2/7
D. 2s后,B的浓度为0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,在两个起始容积都为1L的恒温密闭容器发生反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A. 反应过程中,容器Ⅰ与容器Ⅱ中的总压强的比为1:3
B. 两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C. 温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=![]() 成立
成立
D. 达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时ν正>ν逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g),反应过程如下图所示,下列说法正确的是
2NH3(g),反应过程如下图所示,下列说法正确的是

A. t1 min时正、逆反应速率相等
B. X曲线表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的平均反应速率v(H2)=3/4 mol·L-1·min-1
D. 10~12 min,N2的平均反应速率v(N2)=0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
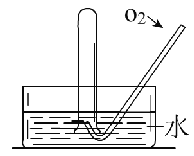
【题目】如图所示,将一瓶充满NO2气体的试管倒扣在水槽中,气体颜色由____逐渐变为____色,试管内的液面会逐渐_____________;当反应停止后向试管中缓慢通入氧气,气体颜色又由______色逐渐变为______色,之后又变为______色,试管内的液面会____________。用化学方程式表示试管中发生的化学反应_____________,____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com