
【题目】温度为T时,在两个起始容积都为1L的恒温密闭容器发生反应:H2(g)+I2(g) ![]() 2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
A. 反应过程中,容器Ⅰ与容器Ⅱ中的总压强的比为1:3
B. 两容器达平衡时:c(HI,容器Ⅱ)>3c(HI,容器Ⅰ)
C. 温度一定,容器Ⅱ中反应达到平衡时(平衡常数为K),有K=![]() 成立
成立
D. 达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时ν正>ν逆
【答案】AC
【解析】该反应为气体体积不变的反应,根据表中数据可知,以上两容器中反应为等温等压下的等效平衡,A.假设能按比例完全转化为HI,则容器Ⅰ与容器Ⅱ的物质的量之比为1:3,体积相同,则反应过程中,容器Ⅰ与容器Ⅱ中的总压强的比为1:3,选项A正确;B、两容器达平衡时:c(HI,容器Ⅱ)=3c(HI,容器Ⅰ),B错误;C、温度一定,容器Ⅱ中反应达到平衡时v正=v逆,由v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2)得c(H2)·c(I2)= ![]() ,由v逆=v(HI)消耗=k逆c2 (HI)得c2 (HI)=
,由v逆=v(HI)消耗=k逆c2 (HI)得c2 (HI)= ![]() ,则有K=
,则有K=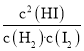 =
=![]() =
=![]() ,选项C正确;D、容器Ⅰ达平衡时,H2、I2、HI的浓度分别为0.07 mol·L-1、0.07 mol·L-1、0.03 mol·L-1,K=
,选项C正确;D、容器Ⅰ达平衡时,H2、I2、HI的浓度分别为0.07 mol·L-1、0.07 mol·L-1、0.03 mol·L-1,K=![]() ,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时Q=
,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时Q=![]() >K,ν逆>ν正,选项D错误。答案选AC。
>K,ν逆>ν正,选项D错误。答案选AC。


科目:高中化学 来源: 题型:
【题目】(1)把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红。填空完成问题:
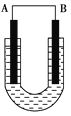
①A是原电池的_______极,代表金属____(填“铜”或“铁”);
②电极方程式分别为正极:______________________,原电池反应为_____________________________________。
(2)请从图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25 mL),并检验氯气的氧化性。
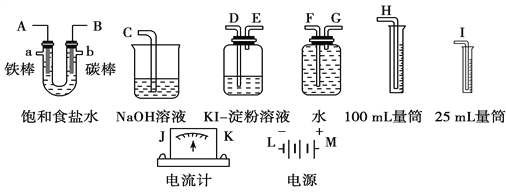
①A极发生的电极反应式是________________,B极发生的电极反应式是_______________。
②设计上述气体实验装置时,各接口的正确连接顺序为_________________________________________________________。
③实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如图所示实验。
Ⅰ.实验探究
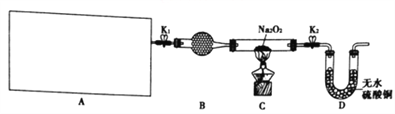
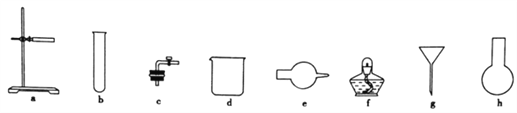
(1)图中A是制取氢气的装置,从图所示的仪器中选择一部分组装成一套能随开随停的装置,选择的仪器编号是_________。
(2)装置A中用粗锌和稀盐酸制取氢气,B装置中所盛放的试剂是_________,其作用是________。
(3)下面是实验过程中的重要操作,正确的顺序是_________(填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间 B.用小试管收集气体并检验其纯度
C.打开K1、K2 通入氢气 D.停止加热,充分冷却,关闭K1、K2
(4)实验过程中观察到淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推出Na2O2与H2反应的化学方程式为___________________________________________________。
Ⅱ.数据处理
(5)实验结束后,该同学欲测定C 装置硬质玻璃管内白色固体中未反应完的Na2O2含量。其操作流程如下:![]()
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和_________,操作2的名称是_________。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_________(填“偏 大” “偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶硅是典型的无机非金属材料,又称“半导体”材料.它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备:

下列说法不正确的是
A. 步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 步骤①中每生成1mol Si,转移4mol电子
C. 高纯硅是制造太阳能电池的常用材料,二氧化硅是制造光导纤维的基本原料
D. SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀碳酸钙主要用于食品、医药等行业。以精选石灰石(含有少量MgCO3、FeCO3杂质)为原料制备沉淀碳酸钙的工艺流程如下:

(1)流程中可以循环利用的物质有气体Ⅰ、气体Ⅱ和__________(填化学式)。
(2)“碳化”时发生反应的离子方程式为________________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________________。
(3)工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:

①电解过程中,加入氯化钙的目的是________________。
②石墨电极发生的电极反应方程式为________________。
③电解得到的Na中约含1%的Ca,除去其中少量Ca的方法为________________。
已知部分物质的熔沸点如下表:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是一种简单易行、行之有效的科学方法,人们在认识事物时可以采取多种分类方法.下列关于“H2CO3”的分类不正确的是( )
A.二元酸
B.强电解质
C.含氧酸
D.弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg 和 Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/(kJ·mol1) | 786 | 715 | 3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是______,Na核外有__________种不同的能级。
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可用右图简单表示,其中配位键和氢键均采用虚线表示。

①SO42 中S的杂化类型是____________,与其互为等电子体的离子有___________(任写两种)
②已知 [Cu(NH3)4]2+ 具有对称的空间构型,[Cu(NH3)4]2+ 中的两个NH3被 Cl 取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_______________。
③写出基态Cu2+ 的价层电子排布式:_________;金属铜采取_________堆积方式,已知Cu原子的半径为 r pm,NA 表示阿伏加德罗常数的值,金属铜的密度是_______________g/cm3(列出计算式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com