
 .
.分析 Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O中,Cu元素的化合价升高,S元素的化合价降低,该反应转移2e-,以此来解答.
解答 解:①Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O中,铜元素的化合价由0价→+2价,失电子被氧化,硫元素的化合价由+6价→+4价,所以硫酸得电子作氧化剂,
故答案为:Cu;硫酸;
②铜失电子数=1(2-0)=2,硫酸得电子数=1(6-4)=2,该反应中转移电子数是2,用用双线桥标出该反应电子转移的方向和数目为: ,故答案为:
,故答案为: ;
;
③该反应中有一半的硫酸是氧化剂,一半的硫酸起酸的作用,所以若有2.4mol的H2SO4参与反应,则被还原的H2SO4的物质的量是1.2mol,其质量=1.2mol×98g/mol=117.6g,由反应可知生成生成标况下的二氧化硫气体为2.4mol×$\frac{1}{2}$×22.4L/mol=26.88L,
故答案为:117.6;26.88.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子转移的表示方法,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加足量BaCl2溶液,反应后进行过滤、洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数为2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
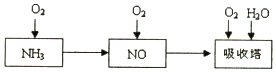
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、HBr、HI的热稳定性依次增强 | B. | KOH的碱性比NaOH的碱性强 | ||
| C. | HBrO4酸性比HClO4强 | D. | Na的金属性比Al的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
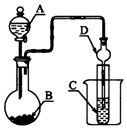
| A. | 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色 | |
| B. | 若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 | |
| C. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色 | |
| D. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com