
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
分析 (1)实验①、②的温度不同,故可探究温度对反应速率的影响,而要探究温度对反应速率的影响,则必须保持其他影响因素一致;
(2)实验①、③的温度相同,加入硫酸的量不同,即硫酸的浓度不同,故可探究浓度对反应速率的影响.
解答 解:(1)实验①、②的温度不同,故可探究温度对反应速率的影响,要探究温度对反应速率的影响,则必须保持其他影响因素一致:即加入的Na2S2O3溶液的量相同,故V1=10.0mL,加入的硫酸的量相同,故V2=10.0mL,加入水的体积相等,故V3=0,
故答案为:温度;0;
(2)实验①、③的温度相同,加入硫酸的量不同,即硫酸的浓度不同,故可探究浓度对反应速率的影响,加入Na2S2O3溶液的量要相同,则V4=10.0,实验①、③的溶液总体积相同,都是20mL,只有加入硫酸的量不同,所以V5=6.0,
故答案为:浓度;6.0.
点评 本题考查对影响反应速率的因素的探究实验,应注意的是在探究一个对反应速率的影响因素的时候,应保持其他的影响因素一致,题目比较简单,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗的上层液体应由上口到出 | |
| B. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| C. | 配置0.1000mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 锥形瓶用作反应容器时可以加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
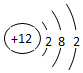
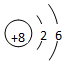 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
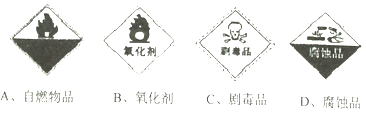
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中酒精灯着火,立即用水扑灭 | |
| B. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com