
| A、①>②>③>④ |
| B、②>①>④>③ |
| C、③>④>①>② |
| D、④>③>②>① |


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:

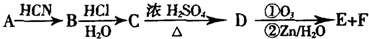
查看答案和解析>>
科目:高中化学 来源: 题型:
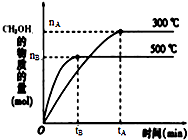 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于0.2mol |
| B、0.2mol |
| C、0.4mol |
| D、0.2mol和0.4mol之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、② | B、②③④ | C、只有④ | D、① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小 |
| B、溶度积常数Ksp只受温度影响,温度升高Ksp减小 |
| C、溶度积常数Ksp只受温度影响,温度升高Ksp增大 |
| D、常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
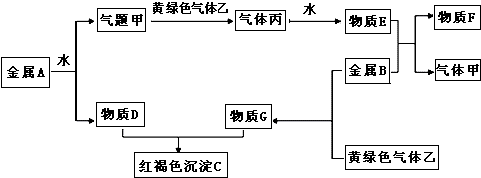
查看答案和解析>>
科目:高中化学 来源: 题型:
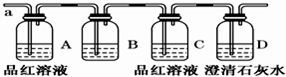
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com