
| 北京市医疗机构临床检验结果报告单 | ||||
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌(Zn) | 115.92 | μmol/L | 66-120 |
| 2 | 铁(Fe) | 6.95↓ | mmol/L | 7.52-11.82 |
| 3 | 钙(Ca) | 1.68 | mmol/L | 1.55-2.10 |
| … | ||||
分析 (1)根据检测结果和参考范围解题;
(2)μmol/L是浓度的单位;
(3)反应中Fe3+转化为Fe2+为被还原的过程,则维生素C所起还原作用;
(4)FeSO4易被氧化而变质,被氧化生成Fe3+.
解答 解:(1)铁(或Fe)元素含量偏低,故答案为:铁(或Fe);
(2)报告单中μmol/L是浓度的单位,故答案为:浓度;
(3)服用维生素C可使食物中的Fe3+转化为Fe2+,Fe元素的化合价降低被还原,则则维生素C所起还原作用,故答案为:还原性;
(4)FeSO4易被氧化而变质,糖衣可起到保护FeSO4不被空气中的氧气氧化,故答案为:防止Fe2+被氧化.
点评 本题考查微量元素对人体健康的重要作用以及氧化还原反应,侧重于化学与生活、生产的考查,注意从元素化合价的角度理解相关概念和物质的性质,题目难度不大.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
| A. | a=1.64 | |
| B. | 此时刻正反应速率大于逆反应速率 | |
| C. | 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大 | |
| D. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3常用作制冷剂 | B. | Fe3O4常用于红色油漆和涂料 | ||
| C. | Na2SiO3常用作制木材防火剂 | D. | NaHCO3常用作面粉发泡剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 二氧化硅溶于NaOH溶液:SiO2+2OH-═SiO32-+H2O | |
| C. | 单质钠放入水中,产生气体:Na+H2O═Na++OH-+H2↑ | |
| D. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
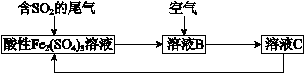
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
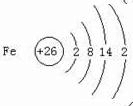 .与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.
.与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com