
已知反应式:①H2S+I2=S↓+2H++2I- ②H2SO3+2H2S=3S↓+3H2O ③2I-+Br2=I2+2Br-
④H2SO3+I2+H2O=SO42-+2I-+4H+,下列各组中还原性由强到的是
| A.H2S、H2SO3、I-、Br- |
| B.I-、Br-、H2SO3、H2S |
| C.H2S、I-、Br-、H2SO3 |
| D.I-、Br-、H2S、H2SO3 |
A
解析试题分析:在氧化还原反应中还原剂的还原性强于还原产物的还原性,据此可以解答。根据反应H2S+I2=S ↓+2H++2I-可知,还原剂是H2S,还原产物是碘离子,则还原性强弱顺序是H2S>I-;在反应H2SO3+2H2S=3S↓+3H2O中还原剂是H2S,亚硫酸是氧化剂,因此还原性强弱顺序是H2S>H2SO3;在反应2I-+Br2=I2+2Br-中,还原剂是碘离子,还原产物是溴离子,则还原性强弱顺序是I->Br-;在反应H2SO3+I2+H2O=SO42-+2I-+4H+中还原剂是亚硫酸,还原产物是碘离子,则还原性强弱顺序是H2SO3>I-,综上所述还原性强弱顺序是H2S、H2SO3、I-、Br-,答案选A。
考点:考查还原性强弱顺序判断


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:单选题
下列反应属于氧化还原反应,但水既没有做氧化剂又没有做还原剂的是
| A.2F2+2H2O ="4HF" +O2 |
| B.3NO2+H2O =2HNO3+NO |
| C.2Na +2H2O=2NaOH+H2 |
| D.CaO+H2O =Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
水在氧化还原反应中可以是氧化剂、还原剂、同时既是氧化剂又是还原剂、既不是氧化剂又不是还原剂等。下列反应与Cl2+SO2+2H2O→H2SO4+2HCl比较,水的作用不相同的是
①2Na2O2+2H2O→4NaOH+O2↑
②4Fe(OH)2+O2+2H2O→4Fe(OH)3
③2F2+2H2O→4HF+O2
④2Al+2NaOH+2H2O→2NaAlO2+3H2↑
| A.①③ | B.③④ | C.①④ | D.②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中,正确的是
| A.只含有金属元素的离子不一定是阳离子 |
| B.金属阳离子被还原不一定得到金属单质 |
| C.氧化还原反应中,非金属单质必是氧化剂 |
| D.元素从化合态变为游离态时,一定被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学方程式为2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,
则下列有关说法中不正确的是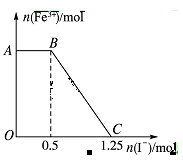
| A.图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol |
| D.向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
①7Li+中含有的中子数与电子数之比为2:1
②在C2H6分子中极性共价键与非极性共价键数之比为3:1
③常温下,11.2 L的甲烷气体中含有的氢、碳原子数之比为4:1
④5.6 g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1
| A.①② | B.②③ | C.①③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据反应式:①2Fe3++2I- 2Fe2++I2和② Br2+2Fe2+
2Fe2++I2和② Br2+2Fe2+ 2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是( )
2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是( )
| A.Br-、Fe2+、I- | B.I-、Fe2+、Br- |
| C.Br-、I-、Fe2+ | D.Fe2+、I-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应中,硝酸既表现酸性,又表现氧化性的是( )。
| A.Fe2O3跟稀硝酸反应 | B.铜跟稀硝酸反应 |
| C.CuO跟稀硝酸反应 | D.Al(OH)3跟稀硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.Al2O3是氧化剂,C是还原剂 | B.每生成1molCO需转移2mol电子 |
| C.AlN中氮元素的化合价为+3 | D.AlN的摩尔质量为41 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com