
【题目】下列实验可达到实验目的的是( )
A. 将苯与浓硝酸、浓硫酸的混合物在60℃水浴加热条件下反应可生成硝基苯
B. 用酸性高锰酸钾溶液即可检验CH2=CH-CHO中的碳碳双键
C. 将![]() 与NaOH的醇溶液共热制备CH3—CH═CH2
与NaOH的醇溶液共热制备CH3—CH═CH2
D. 淀粉在硫酸催化作用下水解,将银氨溶液加入到水解后的溶液中可检验淀粉水解的产物葡萄糖
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以环戊烷为原料制备环戊二烯的合成路线如图,则下列说法正确的是( )
![]()
A. A的结构简式是![]()
B. ①②的反应类型分别是取代、消去
C. 反应②③的条件分别是浓硫酸加热、光照
D. 加入酸性KMnO4溶液,若溶液褪色则可证明![]() 已完全转化为
已完全转化为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.  正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7是重要氧化剂。工业制备重铬酸钾的原理是:将铬铁矿与纯碱按一定比例混合在高温下煅烧:①4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2;②2Na2CrO4+H2SO4=Na2Cr2O7+H2O+Na2SO4;③Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。下列有关说法正确的是
2Fe2O3+8Na2CrO4+8CO2;②2Na2CrO4+H2SO4=Na2Cr2O7+H2O+Na2SO4;③Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。下列有关说法正确的是
A.反应①中Na2CO3作还原剂
B.反应①中每生成80gFe2O3转移7mol电子
C.反应②中,可以用浓盐酸替代硫酸
D.反应③符合溶解度较小物质转化成溶解度较大的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组选用酸性高锰酸钾溶液和草酸(H2C2O4)溶液,探究外界条件对化学反应速率的影响,进行了如下三组实验:[实验内容及记录]
已知:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
_mol·L-1H2C2O4溶液 | H2O | 0.05 mol·L-1KMnO4溶液 | 3 mol·L-1稀硫酸 | ||
1 | 3.0 | 1.0 | 4.0 | 2.0 | 4.0 |
2 | 2.0 | 2.0 | 4.0 | 2.0 | 5.2 |
3 | 1.0 | 3.0 | 4.0 | 2.0 | 6.4 |
请回答:
(1)[实验原理]_____________(写离子方程式)。
(2)为完成实验目的,H2C2O4溶液的物质的量浓度不低于________。
(3)根据上表中的实验数据,可以得到的结论是_________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设。并继续进行实验探究。

①该小组同学提出的假设是__________。
②请你帮助该小组同学完成实验方案。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量MnSO4 | 室温下溶液颜色褪至无色所需时间/min | |||
__mol·L-1 H2C2O4溶液 | H2O | 0.05 mol·L-1 KMnO4溶液 | 3 mol·L-1 稀硫酸 | |||
4 | 3.0 | 1.0 | 4.0 | 2.0 | 0.1 g | t |
若该小组同学提出的假设成立,应观察到的现象_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
![]()
![]()
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
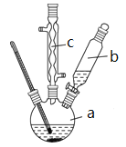
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是_____________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。仪器c的名称及作用是______________。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是______________。下列仪器中可用于分离苯乙酸粗品的是__________ (填编号)。
A.分液漏斗B.漏斗C.烧杯D.直形冷凝管E.玻璃棒
(3)提纯粗苯乙酸的方法是___________________。
(4)用CuCl22H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是_______________________。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:![]() ,已知反应过程中某一时刻
,已知反应过程中某一时刻![]() 、
、![]() 、
、![]() 的浓度分别为
的浓度分别为![]() 、
、![]() 、
、![]() ,当反应达到平衡时,可能存在的数据是( )
,当反应达到平衡时,可能存在的数据是( )
A.![]() 为
为![]() 、
、![]() 为
为![]() B.
B.![]() 为
为![]()
C.![]() 为
为![]() 、
、![]() 为
为![]() D.
D.![]() 和
和![]() 均为
均为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:
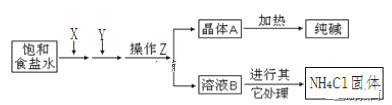
(1)在饱和食盐水中通入X和Y,则X____(填物质名称)
(2)写出通入X和Y的化学反应方程式_____。
(3)操作Z____(填名称),为了得到化肥(NH4Cl),需要在溶液B中通入NH3、加食盐,其中通入NH3的作用一____,作用二____。
(4)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:①称取样品ag,加水溶解;②加入足量的BaCl2溶液;③过滤、___、烘干、冷却、称量、烘干、冷却、___,最终得到固体bg。样品中纯碱的质量分数为____(用含a、b的代数式)
(5)某课外活动小组要用NaOH溶液和CO2来制备Na2CO3固体,他们只有未知浓度的NaOH溶液50毫升和足量的CO2,他们的设计方案是:首先_____,然后_____,加热_____后,再____,最后加热浓缩,冷却结晶,过滤得固体Na2CO3 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com