
【题目】K2Cr2O7是重要氧化剂。工业制备重铬酸钾的原理是:将铬铁矿与纯碱按一定比例混合在高温下煅烧:①4Fe(CrO2)2+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2;②2Na2CrO4+H2SO4=Na2Cr2O7+H2O+Na2SO4;③Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。下列有关说法正确的是
2Fe2O3+8Na2CrO4+8CO2;②2Na2CrO4+H2SO4=Na2Cr2O7+H2O+Na2SO4;③Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。下列有关说法正确的是
A.反应①中Na2CO3作还原剂
B.反应①中每生成80gFe2O3转移7mol电子
C.反应②中,可以用浓盐酸替代硫酸
D.反应③符合溶解度较小物质转化成溶解度较大的物质
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,X比Y的原子系数小1,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A.Y原子能形成四核18电子的电中性分子
B.元素非金属性的顺序为X>Y>Z
C.W的单质与氧气反应不能产生含共价键的化合物
D.该新化合物中Y不满足最外层8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1 mol O2(g)中的化学键需要吸收498 kJ的能量。根据能量变化示意图,下列说法不正确的是
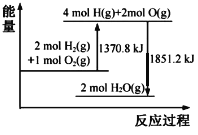
A.2H2(g)+O2(g)=2H2O(l) △H=-480.4 kJ·molˉ1
B.H2O(g)=H2(g)+![]() O2(g) △H=240.2 kJ·molˉ1
O2(g) △H=240.2 kJ·molˉ1
C.拆开1 mol H2(g)中的化学键需要吸收436.4 kJ的能量
D.H2(g)和O2(g)形成H2O(g)中的1 mol H-O键放出462.8 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:

下列叙述错误的是
A.重晶石和钡餐的化学成分相同
B.Y气体的循环使用可以防止污染空气并能提高原料利用率
C.Z(aq)中的阴离子是OH-和CO32-
D.高温煅烧过程中焦炭的作用是为反应提供热量和作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是

A. 由①、②可知, pH越大,+2价铁越易被氧化
B. 由②、③推测,若pH>7,+2价铁更难被氧化
C. 由①、③推测,FeCl2被O2氧化的反应为放热反应
D. 60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可达到实验目的的是( )
A. 将苯与浓硝酸、浓硫酸的混合物在60℃水浴加热条件下反应可生成硝基苯
B. 用酸性高锰酸钾溶液即可检验CH2=CH-CHO中的碳碳双键
C. 将![]() 与NaOH的醇溶液共热制备CH3—CH═CH2
与NaOH的醇溶液共热制备CH3—CH═CH2
D. 淀粉在硫酸催化作用下水解,将银氨溶液加入到水解后的溶液中可检验淀粉水解的产物葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下某烃与H2按物质的量之比1:2加成生成C2H5CH (CH3)2,则该烃的结构简式为(任写1种)______________________。
(2)分子式为C4H8的烃,核磁共振氢谱图中有两个吸收峰,峰面积比为3:1,请写出符合条件的2种物质的结构简式___________________、_____________________。
(3)有机物甲的结构简式如下,它可通过不同的化学反应分别制得结构简式为乙~庚的物质。

请回答下列问题:
①在甲~庚七种物质中,互为同分异构体的是_________________(填编号,下同),可看作酯类的是___________________。
②写出由甲生成高分子化合物的方程式:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧B. ①④⑤⑥⑦⑧C. ③④⑤⑥⑦D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com