
分析 因为铁粉恰好完全反应无剩余,所以过滤得到的固体就只有铜单质,假设过滤得到的铜为6.4g,那么根据铁和硫酸铜反应的化学方程式,由铜的质量可求出与硫酸铜和与其反应的铁的质量,进而求出与硫酸反应的铁的质量,最后根据铁和硫酸反应的方程式求出硫酸的质量,进而求得质量比.
解答 解:假设生成的铜的质量为6.4g,
设与硫酸铜反应的铁的质量为x所含CuSO4与的质量为y,
Fe+CuSO4═FeSO4+Cu
56 160 64
x y 6.4g
则:x=$\frac{6.4g×56}{64}$=5.6g y=$\frac{6.4g×160}{64}$=16g,
与硫酸反应的铁的质量为:6.4g-5.6g=0.8g,
设混合溶液中所含H2SO4的质量为z,
Fe+H2SO4═FeSO4+H2↑
56 98
0.8g z
则z=$\frac{98×0.8g}{56}$=1.4g,
混合溶液中所含H2SO4与CuSO4的质量比为:1.4g:16g═7:80
故答案为:7:80.
点评 本题考查混合物反应的计算,题目难度中等,涉及的化学方程式有两个,做此题首先需正确写出这两个方程式,然后认真审题获得有利数据来解答此题,试题培养了学生的化学计算能力.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:选择题
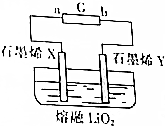 据英国《金融时报》网站最近报道,英国科学家研制出一种超容量的锂电池.其简易电池工作原理如图所示.X、Y是用石墨烯制成的渗透性极好的“蓬松”电极,其中石墨烯X极附着锂.该电池的工作原理是Li(s)+O2(g)$?_{充电}^{放电}$LiO2(s).下列说法不正确的是( )
据英国《金融时报》网站最近报道,英国科学家研制出一种超容量的锂电池.其简易电池工作原理如图所示.X、Y是用石墨烯制成的渗透性极好的“蓬松”电极,其中石墨烯X极附着锂.该电池的工作原理是Li(s)+O2(g)$?_{充电}^{放电}$LiO2(s).下列说法不正确的是( )| A. | 充电过程,电源G的b极为负极 | |
| B. | 放电过程,Y极发生还原反应 | |
| C. | 放电过程,X极的电极反应式为Li-e-+O2-═LiO2 | |
| D. | 充电过程,每转移2 mol电子,Y极放出44.8L(标准状况)O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.10 mol•L-1AgNO3 | B. | 0.20 mol•L-1Zn(NO3)2 | ||
| C. | 0.20 mol•L-1Cu(NO3)2 | D. | 0.20 mol•L-1Pb(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
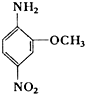 2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )
2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )| A. | 6种 | B. | 7种 | C. | 9种 | D. | 10种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com