
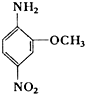
 2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )
2-氨基-5-硝基苯甲醚俗称红色基B,其结构简式如右所示.若化学式与红色基B相同,且氨基与硝基直接连在苯环上并呈对位时的同分异构体数目(不包括红色基B)可能为( )| A. | 6种 | B. | 7种 | C. | 9种 | D. | 10种 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,KW增大,pH变小 | |
| B. | 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸,c(H+)增大,KW变小 | |
| D. | 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

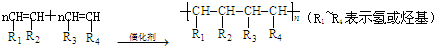
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质的种类很多,它们都能溶解于水 | |
| B. | 蛋白质水解的最终产物是氨基酸 | |
| C. | 蛋白质溶液中加入浓盐酸,颜色变黄 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质将变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | M是直流电的正极 | B. | 电子流向是N→b→a→M | ||
| C. | 电解过程中,水是氧化剂 | D. | b电极附近溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在NaHS溶液中滴入少量的CuCl2溶液产生黑色沉淀,HS-电离程度增大,反应后溶液pH减小 | |
| B. | 浑浊的苯酚试液中加入饱和Na2CO3溶液变澄清,则酸性:苯酚>碳酸 | |
| C. | 在等浓度NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl,则Ksp(AgCl)<Ksp(Ag2CrO4) | |
| D. | 等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com