
【题目】下列说法正确的是
A.油脂水解可得到氨基酸和甘油
B.结构片段![]() 的高聚物,其单体是苯酚和甲醛
的高聚物,其单体是苯酚和甲醛
C.检验淀粉在稀硫酸条件下水解产物的方法是:取适量水解液于试管中,加入少量新制 Cu(OH)2 悬浊液,加热,观察是否有砖红色沉淀
D.鸡蛋清溶液中加入饱和硫酸铵溶液、饱和硫酸铜溶液均会发生盐析而凝聚
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】以冶炼金属铝的废弃物铝灰为原料制取超细α-氧化铝,既能降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:

(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为_____(填选项编号)。

(2)流程中加入H2O2有气体产生,原因是___________________________________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3.已知:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 3.7 |
完全沉淀时的pH | 3.2 | 9.0 | 4.7 |
为保证产品的纯度,可以选用下列物质中的_______调节溶液pH(填字母),调节pH的范围为______________。
a.Al2O3 b.NaOH c.Al(OH)3 d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)212H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置:

①集气瓶中收集到的气体是____________(填化学式)。
②装有KMnO4溶液洗气瓶的作用是____________________________。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂_________。写出硫酸铝铵加入足量该试剂的离子方程式__________________________________________________。
④20℃时,0.1mol·L-1硫酸铝铵,其溶液pH=3,则溶液中,2c(SO42-)-c(NH4+)-3c(Al3+)=____________mol·L-1(填具体数字计算式,不必化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验,完成下列各问题

(1)B中溶液褪色,是因为乙烯被_______________;
(2)C中发生反应的化学方程式________________;
(3)在D处点燃时必须进行的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。下图是工业生产纳米磁性氧化铁的流程:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
下列说法不正确的是
A.用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B.若生产中不通入N2,暴露在空气中生产,将不能得到高纯度产品
C.加适量的H2O2是为了将部分Fe2+氧化为Fe3+ ,涉及的反应:H2O2+2Fe2++2H+=2Fe3++2H2O
D.溶液A中Fe2+和Fe3+的浓度比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图所示。

已知:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃。
请回答:
(1)仪器A的名称为________;仪器B的作用是________;冰水浴冷却的目的是____________(写出两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因______________。
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①_______________________________(用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,煤的气化和液化是高效、清洁、综合利用煤炭的重要途径。
(1)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
①T1___T2(填“>、<或=”)。
②T1时达到平衡后再加入1molH2O(g),达到新平衡后H2(g)的物质的量分数___(填“增大”“不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v正___v逆(填“>、<或=”)。
(2)煤液化时发生反应:CO(g)+2H2(g)![]() CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:
CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH2___0(填“>、<或=”)。
②下列说法正确的是___(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强P1<P2
③0-3min内用CH3OH表示的反应速率v(CH3OH)=___mol/(L·min)(结果保留两位有效数值)。
④200℃时,该反应的平衡常数K=___。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变,则化学平衡___(填“正向”、“逆向”或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列工业生产所涉及的化学用语表达不正确是
A.工业上制取氯气:MnO2+4HCl![]() Cl2↑+MnCl2+H2O
Cl2↑+MnCl2+H2O
B.工业上合成氨:N2+3H2![]() 2NH3
2NH3
C.工业上制取粗硅:SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.工业上生产漂白粉:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 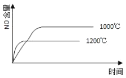
B. 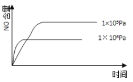
C. 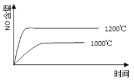
D. 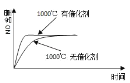
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月第四届国际碳材料大会在上海举行,碳材料产品丰富,应用广泛,让人感到“碳为观止”。下列有关说法正确的是
A.金刚石与石墨互为同位素
B.石墨烯是一种有发展前途的导电材料
C.碳纤维、合成纤维、光导纤维都属于高分子材料
D.富勒烯是由60个碳原子都以碳碳单键构成的分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com