
| V |
| Vm |
| 1.904L |
| 22.4L/mol |
| 8.5g |
| 10g |


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
| A、硫黄是一种易溶于水的黄色晶体 |
| B、SO2的水溶液显酸性 |
| C、SO2是黄色易溶于水的有毒气体 |
| D、SO2不稳定,极易转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
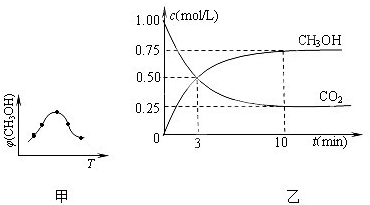
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | b | c | d | |
| e |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此温度下,液氨的离子积等于1×10-30 |
| B、在液氨中放人NaNH2,则液氨的离子积数值将增大 |
| C、此温度下,在液氨中加人NaNH2,则液氨中c(NH4+)<1×10-15mol/L |
| D、在液氨中加入NH4Cl,则液氨中c(NH4+)将大于c(NH2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2和Na2CO3 |
| B、Na2O2和NaOH |
| C、Na2CO3和NaOH |
| D、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com