
| ||
| 1.12L |
| 22.4L/mol |
| 0.9g |
| 27g/mol |
| 1 |
| 30 |
| 1 |
| 30 |
| ||
| 1.12L |
| 22.4L/mol |
| 0.9g |
| 27g/mol |
| 1 |
| 30 |
| 1 |
| 30 |
| ||
 ,
, ;
;

科目:高中化学 来源: 题型:
| A、常温下浓H2SO4能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 |
| B、Cl2能与石灰乳反应,可用于制取漂白粉 |
| C、二氧化氯具有氧化性,可用于自来水的杀菌消毒 |
| D、石墨具有导电性,可用于制造半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,pH=13的溶液中:K+、Al3+、Cl-、SO42- |
| B、含有1mol?L-1Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| C、由水电离的c(H+)=10-12 mol?L-1的溶液中,K+、Na+、Cl-、SO4 |
| D、室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
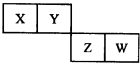 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )| A、原子半径的大小顺序为:rZ>rW>rX>rY |
| B、元素W的含氧酸的酸性一定比Z的含氧酸的酸性强 |
| C、工业上是通过热还原获得元素W的单质 |
| D、XZ2和XW4中化学键的类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com