
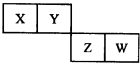
 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )| A、原子半径的大小顺序为:rZ>rW>rX>rY |
| B、元素W的含氧酸的酸性一定比Z的含氧酸的酸性强 |
| C、工业上是通过热还原获得元素W的单质 |
| D、XZ2和XW4中化学键的类型不同 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、NaHCO3溶液中碳元素主要以HCO3-存在 |
| B、Na2CO3溶液中滴加酚酞呈红色,加热红色变深 |
| C、NH4Cl溶液呈酸性这一事实能说明一水合氨为弱碱 |
| D、在稀醋酸中加醋酸钠固体能促进醋酸的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何粒子的数目都约为6.02×1023 |
| B、0.012kg 12C约含6.02×1023个碳原子 |
| C、使用物质的量时,应用化学式指明粒子的种类 |
| D、O2的摩尔质量等于它的相对分子质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com