


 培优口算题卡系列答案
培优口算题卡系列答案科目:高中化学 来源: 题型:
| A、碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、向NaHCO3溶液中滴加AlCl3溶液:Al3++3HCO3-═Al(OH)3↓+3CO2↑ |
| C、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| D、SO2气体通入Ba(NO3)2溶液中:SO2+H2O+Ba2+═BaSO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
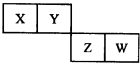 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )| A、原子半径的大小顺序为:rZ>rW>rX>rY |
| B、元素W的含氧酸的酸性一定比Z的含氧酸的酸性强 |
| C、工业上是通过热还原获得元素W的单质 |
| D、XZ2和XW4中化学键的类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com