
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
| 选项 | 化学反应及离子方程式 | 评价 |
| A | 将铝粉加入含氢氧化钠溶液中: 2Na++2OH-+2Al+H2O=2Na++AlO2-+3H2↑ | 正确 |
| B | Na2O2与H2O反应: Na2O2+H2O═2Na++2OH-+O2↑ | 错误,氧元素不守恒 |
| C | 碳酸氢钠与醋酸反应: HCO3-+H+=H2O+CO2↑ | 正确 |
| D | 向FeCl3溶液中滴加足量氨水: Fe3++3OH-═Fe(OH)3↓ | 正确 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
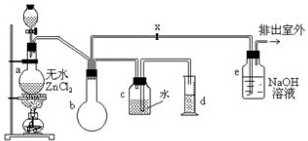
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应的氧化剂是C2O42- |
| B、该反应右边方框内的产物是OH- |
| C、该反应中生成1molCO2电子转移数总是5NA |
| D、配平该反应式后,H+的系数是16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com