
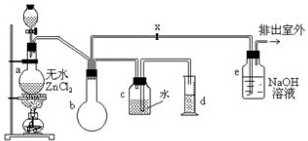
| �� |
| ZnCl2 |
| �� |
| ZnCl2 |
| ��ȼ |
| ��ȼ |
| �� |
| ZnCl2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����������Һ�м���ʳ�λ���ְ�ɫ���� |
| B��Ŀǰ����������Ҫ�Ŀ���ȼ�����Ҵ� |
| C���������������������ֽ��������ȷ�Ӧ |
| D����ѧ��Ӧ�е������仯��ֻ����Ϊ�����ı仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
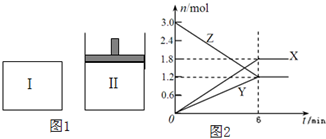 ��ͼ1����һ���¶��£�������������ֱ�ͨ����ʼ�����Ϊ2L���ܱ����������¶ȡ�������䣩�͢����¶ȡ�ѹǿ���䣩�У�ʹ�䷢����Ӧ��6minʱ�������дﵽ��ѧƽ�⣬X��Y��Z�����ʵ����ı仯��ͼ2��ʾ���������й��ƶ���ȷ���ǣ�������
��ͼ1����һ���¶��£�������������ֱ�ͨ����ʼ�����Ϊ2L���ܱ����������¶ȡ�������䣩�͢����¶ȡ�ѹǿ���䣩�У�ʹ�䷢����Ӧ��6minʱ�������дﵽ��ѧƽ�⣬X��Y��Z�����ʵ����ı仯��ͼ2��ʾ���������й��ƶ���ȷ���ǣ�������| A���÷�Ӧ�Ļ�ѧ����ʽΪ��3Z=3X+2Y |
| B�����������о��ﵽƽ��ʱ����������ﵽƽ������ʱ�����t0 |
| C���������У���5minʱZ���������ʴ���X���������� |
| D���������У�ǰ6min��Z�ķ�Ӧ����Ϊ0.3mol/��L?min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com