
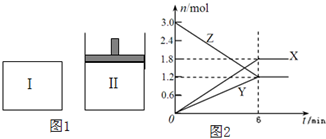
 如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )
如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )| A、该反应的化学方程式为:3Z=3X+2Y |
| B、若两容器中均达到平衡时,则容器Ⅱ达到平衡所需时间大于t0 |
| C、容器Ⅰ中,第5min时Z的消耗速率大于X的消耗速率 |
| D、容器Ⅰ中,前6min内Z的反应速率为0.3mol/(L?min) |
| △c |
| △t |
 3X+2Y,故A错误;
3X+2Y,故A错误; 3X+2Y,相当于在恒容的基础上减小压强,即容器Ⅱ相当于在Ⅰ的基础上减小压强,反应速率减慢,容器Ⅱ达到平衡所需时间大于t0,故B正确;
3X+2Y,相当于在恒容的基础上减小压强,即容器Ⅱ相当于在Ⅰ的基础上减小压强,反应速率减慢,容器Ⅱ达到平衡所需时间大于t0,故B正确;| △c |
| △t |
| ||
| 6min |


科目:高中化学 来源: 题型:
| A、25℃时,PH=12的无色溶液:K+、Br-、SO32-、SiO32- |
| B、与铝粉反应放出极气的溶液:HCO3-、K+、Na+、SO42- |
| C、使石蕊溶液撇红色的溶液:Na+、NH4-、Cl-、S2O32- |
| D、25℃时,由水电离出来的c(H+)=1×10-13mol/L的溶液:Ba2+、Cl-、AlO2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:
元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com