
 元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:
元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分: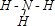 ,故答案为:-3;
,故答案为:-3; ;
; ,
, .
.


科目:高中化学 来源: 题型:
| A、①和② | B、②和③ |
| C、①和③ | D、只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
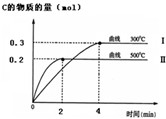 (1)已知在25℃时:①2CO (s)+O2(g)═2CO2(g)△H1=-566KJ/mol
(1)已知在25℃时:①2CO (s)+O2(g)═2CO2(g)△H1=-566KJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:
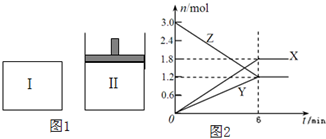 如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )
如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )| A、该反应的化学方程式为:3Z=3X+2Y |
| B、若两容器中均达到平衡时,则容器Ⅱ达到平衡所需时间大于t0 |
| C、容器Ⅰ中,第5min时Z的消耗速率大于X的消耗速率 |
| D、容器Ⅰ中,前6min内Z的反应速率为0.3mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com