
| n |
| c |
| 1 |
| 2 |
| 0.005mol |
| 0.1mol/L |


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:
元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
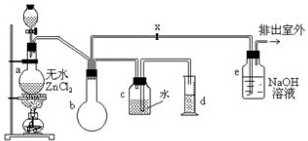
查看答案和解析>>
科目:高中化学 来源: 题型:
A、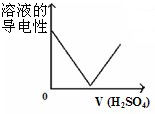 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 |
B、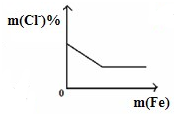 将铁粉加入到一定量FeCl3溶液中 将铁粉加入到一定量FeCl3溶液中 |
C、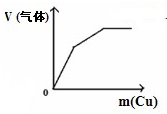 将铜粉加入到一定量浓硝酸中 将铜粉加入到一定量浓硝酸中 |
D、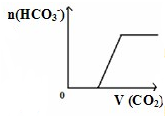 将二氧化碳通入到一定量漂粉精溶液中 将二氧化碳通入到一定量漂粉精溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、产生的NO在标准状况下的体积为28L |
| B、参加反应的硝酸的物质的量为1.5mol |
| C、NO和NO2的物质的量之比为1:5 |
| D、若生成的气体完全被水吸收,需要标准状况下O2的体积为 22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
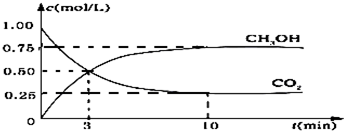
| n(CH3OH) |
| n(H2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com