

| ||
| ||


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,PH=12的无色溶液:K+、Br-、SO32-、SiO32- |
| B、与铝粉反应放出极气的溶液:HCO3-、K+、Na+、SO42- |
| C、使石蕊溶液撇红色的溶液:Na+、NH4-、Cl-、S2O32- |
| D、25℃时,由水电离出来的c(H+)=1×10-13mol/L的溶液:Ba2+、Cl-、AlO2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:丁>丙>甲 |
| B、单质的还原性:丁>丙>甲 |
| C、甲、乙、丙的氧化物为共价化合物 |
| D、乙、丙、丁的最高价氧化物对应的水化物相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:
元素周期表是指导我们系统学习化学的重要工具.下表是元素周期表的一部分:查看答案和解析>>
科目:高中化学 来源: 题型:
A、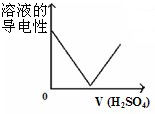 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 |
B、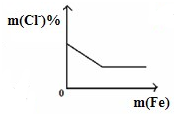 将铁粉加入到一定量FeCl3溶液中 将铁粉加入到一定量FeCl3溶液中 |
C、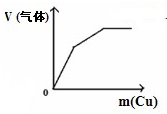 将铜粉加入到一定量浓硝酸中 将铜粉加入到一定量浓硝酸中 |
D、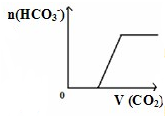 将二氧化碳通入到一定量漂粉精溶液中 将二氧化碳通入到一定量漂粉精溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com