


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、H2(g)+Cl2(g)═2HCl(g);△H=-184.6kJ/mol | ||
B、CO(g)+
| ||
| C、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ/mol | ||
| D、CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质溶液中加入食盐会出现白色沉淀 |
| B、目前世界上最重要的矿物燃料是乙醇 |
| C、葡萄糖在人体内氧化分解属于吸热反应 |
| D、化学反应中的能量变化,只表现为热量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
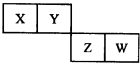 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,Z原子最外层电子数是其电子层数的2倍,下列叙述正确的是( )| A、原子半径的大小顺序为:rZ>rW>rX>rY |
| B、元素W的含氧酸的酸性一定比Z的含氧酸的酸性强 |
| C、工业上是通过热还原获得元素W的单质 |
| D、XZ2和XW4中化学键的类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
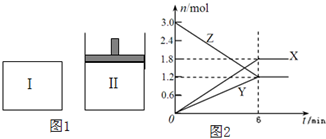 如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )
如图1,在一定温度下,将等量的气体分别通入起始体积均为2L的密闭容器Ⅰ(保持温度、体积不变)和Ⅱ(保持温度、压强不变)中,使其发生反应,6min时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )| A、该反应的化学方程式为:3Z=3X+2Y |
| B、若两容器中均达到平衡时,则容器Ⅱ达到平衡所需时间大于t0 |
| C、容器Ⅰ中,第5min时Z的消耗速率大于X的消耗速率 |
| D、容器Ⅰ中,前6min内Z的反应速率为0.3mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com