
| A. | 等于10s | B. | 等于12s | C. | 小于12s | D. | 大于13s |
分析 恒温恒容条件下,根据v=$\frac{△c}{△t}$计算反应速率,但反应物浓度越小反应速率越小,根据△t=$\frac{△c}{v}$计算反应时间.
解答 解:恒温恒容条件下,前20s平均反应速率v=$\frac{△c}{△t}$=$\frac{(0.1-0.06)}{20}$mol/(L.s)=0.002mol/(L.s),如果反应速率仍然是0.002mol/(L.s),则反应所需时间△t=$\frac{△c}{v}$=$\frac{0.06-0.034}{0.002}$s=13s,但反应物浓度越小反应速率越小,所以所需时间大于13s,故选D.
点评 本题考查化学反应速率的有关计算,为高频考点,明确反应速率与反应物浓度关系是解本题关键,反应物浓度越大反应速率越大,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
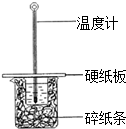 某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定
某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫氢化钠的水解反应 HS-+H2O?S2-+H3O+ | |
| B. | 碳酸氢钙与过量的 NaOH 溶液反应 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | Na2O2与H2O反应制备O2 Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向碳酸钠溶液中加少量盐酸 CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
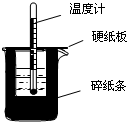 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4 $→_{高温}^{H_{2}}$Si | |
| B. | Mg(OH)2 $\stackrel{盐酸}{→}$NgCl2(ag) $\stackrel{电解}{→}$Mg | |
| C. | Fe2O3 $\stackrel{盐酸}{→}$FeCl3(ag) $\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | Cu $\stackrel{稀硝酸}{→}$NO2 $\stackrel{水}{→}$NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol水和1molH2的 体积都约是22.4L | |
| B. | 2gH2和44gCO2的体积相等 | |
| C. | 1mol某气体的体积为22.4L,则该气 体一定处于标准状况 | |
| D. | 在标准状况下,1molH2和O2的混合气体体积约是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn2++2OH-═Zn(OH)2↓;ZnCO3+2NaOH═Zn(OH)3↓+Na2CO3 | |
| B. | Ba2++SO42-═BaSO4↓;Ba(OH)2+H2SO4═BaSO4↓+2H2O | |
| C. | Ag++Cl-═AgCl↓;AgNO3+NaCl═AgCl↓+NaNO3 | |
| D. | Cu+2Ag+═Cu2++2Ag↓;Cu+2AgCl═2Ag+CuCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com