
【题目】Ⅰ.向甲乙两个容积均为1 L 的恒容容器中,分别充入2 mol A、2 mol B 和1 molA、1 mol B。相同条件下(温度T ℃), 发生下列反应:A(g)+B(g) ![]() xC(g) ΔH<0。测得两容器中 c(A)随时间t 的变化如图所示:
xC(g) ΔH<0。测得两容器中 c(A)随时间t 的变化如图所示:
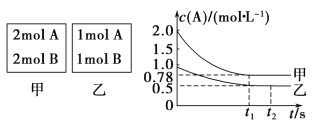
回答下列问题:
(1)乙容器中,平衡后物质 B 的转化率为______________。
(2)x=___________。
(3)T ℃时该反应的平衡常数为___________。
(4)下列说法正确的是______________。
A.向平衡后的乙容器中充入氦气可使 c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内相同
C.若向甲容器中再充入 2 mol A、 2 mol B,则平衡时甲容器中 0.78 mol·L-1<c(A)<1.56mol·L-1
Ⅱ.科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。

(1)上述反应的a___________0(填“大于”或“小于”)。
(2)恒温下,向反应体系中加入固体催化剂,则反应产生的热量________(填“增大”、“减小”或“不变”)。
(3)增大![]() 的值,则生成乙醇的物质的量___________(填“增大”、 “减小”、 “不变”或“不能确定”)。
的值,则生成乙醇的物质的量___________(填“增大”、 “减小”、 “不变”或“不能确定”)。
【答案】Ⅰ.(1)50%(2)1(3)2(4)C
Ⅱ.(2)①小于 ②不变 ③不能确定
【解析】
试题分析:Ⅰ.(1)乙容器中,A参加反应的物质的量=(1-0.5)mol/L×1L=0.5mol,根据A和B的关系式知,参加反应的B的物质的量也是0.5mol,则B的转化率=![]() ×100%=50%。
×100%=50%。
(2)甲容器反应达到平衡后,c(A)=0.78 molL-1,A的转化率=![]() ×100%=61%,乙容器中,A参加反应的物质的量=(1-0.5)mol/L×1L=0.5mol,A的转化率=
×100%=61%,乙容器中,A参加反应的物质的量=(1-0.5)mol/L×1L=0.5mol,A的转化率=![]() ×100%=50%,即压强越大,A的转化率越高,所以正反应为气体体积减小的反应,则x=1。
×100%=50%,即压强越大,A的转化率越高,所以正反应为气体体积减小的反应,则x=1。
(3)反应达到平衡时,乙容器中c(A)=c(B)=c(C)=0.5 molL-1,T℃时,该反应的平衡常数K=![]() =2。
=2。
(4)A.向平衡后的乙容器中充入惰性气体氦气,气体的浓度不变,平衡不发生移动,所以c(A)不变,A错误;B.将乙容器单独升温,平衡逆向移动,A的体积分数增大,更大于甲容器中A的体积分数,B错误;C.若向甲容器中再充入2 mol A、2 mol B,相当于增大压强,平衡向正反应方向移动,则达到平衡时A的转化率比不加前增大,所以平衡时甲容器中0.78 molL-1<c(A)<1.56 molL-1,C正确。答案选C。
Ⅱ.(2)①由图表分析判断,随温度升高,二氧化碳转化率减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应,a小于0故;
②催化剂对化学平衡没有影响,所以加入催化剂,平衡不移动,反应反应热不变;
③氢气和二氧化碳物质的量比值增大,可以是增加氢气,也可能为减小二氧化碳,所以二氧化碳转化率增大,但生成的乙醇的物质的量不一定增大或减小。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】【甘肃兰州一中2015届12月月考】通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热△H为( )
Si(s)+4HCl(g),该反应的反应热△H为( )
A.+236 kJ·mol-1 B.-236 kJ·mol-1 C.+412 kJ·mol-1 D.-412 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 用乙烷和氯气等物质的量混合可以得到纯净的氯乙烷
B. 石油裂解气不能使溴的四氯化碳溶液、酸性KMnO4溶液褪色
C. 水煤气可用来合成液态烃及甲醇等含氧有机物
D. 苯与氯气在光照的条件下通过取代反制得氯苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【天津市红桥区下学期开学考试】向1L的密闭容器中加入1molX、3molZ和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
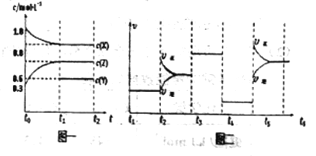
A. Y的起始物质的量为0.5mol
B. 该反应的化学方程式为:2X(g)+Y(g)![]() 3Z(g)ΔH<0
3Z(g)ΔH<0
C. 若t0=0,t1=10s,则t0-t1阶段的平均反应速率为v(z)=0.03mol/(L﹒s)
D. 反应物X的转化率t6点比t3点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是
A. 硝酸钠、氢氧化钠
B. 氧化铜、二氧化锰
C. 氯化钾、二氧化锰
D. 硫酸铜、氢氧化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 实验室用亚硫酸钠与稀硫酸反应制备二氧化硫
B. 用NaOH溶液除去乙酸乙酯中的乙酸
C. 用洁净的铂丝蘸取少量的氯化钾固体置于酒精灯火焰上灼烧可观察到紫色火焰
D. 用冷却热饱和溶液法提纯含少量NaCl杂质的KNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行实验研究(图中a、b、c表示止水夹),请对其方案进行完善或评价。
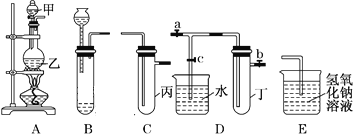
(1)实验室用装置A来制取Cl2,反应的离子方程式是______________;若将装置B、C、E相连后,用浓盐酸和______(填下列试剂的标号)为原料可制取Cl2。
a.KMnO4固体 b.KClO3固体 c.KCl固体 d.浓硫酸
(2)用装置B来制取制取氯气,并将装置B、C、E相连,在丙中加入适量水,即可制得氯水。向该氯水中加入大理石,充分振荡,观察到氯水的黄绿色逐渐褪去,同时产生少量气泡。某同学根据此现象推断出氯水呈酸性,请问该同学的推断是否合理?______________(填“合理”或“不合理”),若不合理,请说明理由(若合理,此空无需填写):_________________。
(3)为了探究氯水与大理石的反应,用装置A来制取氯气,并依次连接装置A、C、C、E。在第一个装置C的丙中,应加入的试剂是____________;在第二个装置C的丙中,加入适量水,即制得氯水。向制得的氯水中加入过量的大理石,反应结束后将所得溶液分成四等分,进行I、Ⅱ、Ⅲ、Ⅳ四个实验,实验操作如下,将实验现象或者实验结论填入下表:
实验序号 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 将该溶液滴在有色布条上 | 有色布条迅速褪色 | ①该溶液中含有__________ |
Ⅱ | 向该溶液中滴加碳酸钠溶液 | ②___________ | 该溶液中含有Ca2+ |
Ⅲ | 向该溶液中滴加稀盐酸 | 有无色气泡产生 | ③无色气体是____________ |
Ⅳ | 加热该溶液 | 溶液变浑浊并产生大量气体 | ④该溶液中含有__________ |
⑤通过上述实验,得出氯水和过量的大理石反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把 0.6molX气体和0.4molY气体混合于2L的密闭容器中,使它们发生如下反应3X(g) + Y(g) ![]() nZ(g)+2W(g),5min末已生成 0.2molW,若测知以 Z 表示的平均反应速率为 0.01mol·L﹣1·min﹣1,则 n是
nZ(g)+2W(g),5min末已生成 0.2molW,若测知以 Z 表示的平均反应速率为 0.01mol·L﹣1·min﹣1,则 n是
A.1 B.4 C.2 D.3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com