
【题目】把 0.6molX气体和0.4molY气体混合于2L的密闭容器中,使它们发生如下反应3X(g) + Y(g) ![]() nZ(g)+2W(g),5min末已生成 0.2molW,若测知以 Z 表示的平均反应速率为 0.01mol·L﹣1·min﹣1,则 n是
nZ(g)+2W(g),5min末已生成 0.2molW,若测知以 Z 表示的平均反应速率为 0.01mol·L﹣1·min﹣1,则 n是
A.1 B.4 C.2 D.3
科目:高中化学 来源: 题型:
【题目】Ⅰ.向甲乙两个容积均为1 L 的恒容容器中,分别充入2 mol A、2 mol B 和1 molA、1 mol B。相同条件下(温度T ℃), 发生下列反应:A(g)+B(g) ![]() xC(g) ΔH<0。测得两容器中 c(A)随时间t 的变化如图所示:
xC(g) ΔH<0。测得两容器中 c(A)随时间t 的变化如图所示:
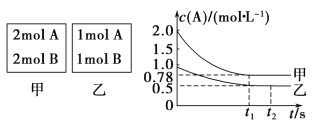
回答下列问题:
(1)乙容器中,平衡后物质 B 的转化率为______________。
(2)x=___________。
(3)T ℃时该反应的平衡常数为___________。
(4)下列说法正确的是______________。
A.向平衡后的乙容器中充入氦气可使 c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内相同
C.若向甲容器中再充入 2 mol A、 2 mol B,则平衡时甲容器中 0.78 mol·L-1<c(A)<1.56mol·L-1
Ⅱ.科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。

(1)上述反应的a___________0(填“大于”或“小于”)。
(2)恒温下,向反应体系中加入固体催化剂,则反应产生的热量________(填“增大”、“减小”或“不变”)。
(3)增大![]() 的值,则生成乙醇的物质的量___________(填“增大”、 “减小”、 “不变”或“不能确定”)。
的值,则生成乙醇的物质的量___________(填“增大”、 “减小”、 “不变”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①②④ B.②③⑤ C.③⑤⑥ D.①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A. ①②③④ B. ③④⑤⑥⑦⑧ C. ③⑤⑥⑦⑧ D. ⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机化合物,它们之间的关系如下所示(提示:RCH===CHR′在KMnO4酸性溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基)

回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为____________。
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为12,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是___________________,反应类型为________。
(3)A可以与金属钠作用放出氢气,能使溴的CCl4溶液褪色,则A的结构简式是___________________。
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有________种,其相应的结构简式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(2)反应2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) 在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(s)+H2O(g) 在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。

图1 图2 图3
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61
生产中应选用水碳比的数值为 (选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是 。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量大约为20%)。
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为 %。
(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。生产中可分离出的物质A的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com