
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(2)反应2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) 在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(s)+H2O(g) 在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。

图1 图2 图3
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61
生产中应选用水碳比的数值为 (选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是 。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量大约为20%)。
②图2是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为 %。
(4)图3表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。生产中可分离出的物质A的化学式为 。
【答案】20.(14分)
(1)+72.49(2分)
(2)①A (2分)
②氨碳比在4.5时,NH3的量增大较多,而CO2的转化率增加不大,提高了生产成本(2分)
(3)①1∶1(2分) ②5(±0.2)% (2分)
(4)N2+6e—+8H+=2NH4+(2分) NH4Cl(2分)
【解析】试题解析: 依据热化学方程式和盖斯定律①+②=③,得到-159.47KJ/mol+a=-86.98KJ/mola=+72.49KJ/mol;答案为:+72.49;(2)①氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为A;答案为:A;②氨碳比在4.5时,需要氨气较多,但依据图象分析二氧化碳转化率增大不多,工业合成氨生成工艺较复杂,提高生产成本;答案为:氨碳比在4.5时,NH3的量增大较多,而CO2的转化率增加不大,提高了生产成本;(3)①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳,即1:1,若烟气中V(NO):V(NO2)=5:1时,设通入空气中氧气体积为x;则2NO+O2=2NO2(5×2x)/(1+2x) =1:1,计算得到x=1;空气体积为5;所以同温同压下,V(空气):V(NO)=1:1②图象分析可知,当尿素浓度为5mol/L左右时,脱氮效率基本不变,所以从经济因素上考虑,一般选择尿素浓度约为5%左右大达到较大的脱氮效率;(4)以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+;负极是氢气失电子生成氢离子,政绩生成铵根离子在电解质溶液溶液中可以分离出氯化铵;
考点: 盖斯定律应用;燃料电池极反应;化学平衡理论应用;


科目:高中化学 来源: 题型:
【题目】把 0.6molX气体和0.4molY气体混合于2L的密闭容器中,使它们发生如下反应3X(g) + Y(g) ![]() nZ(g)+2W(g),5min末已生成 0.2molW,若测知以 Z 表示的平均反应速率为 0.01mol·L﹣1·min﹣1,则 n是
nZ(g)+2W(g),5min末已生成 0.2molW,若测知以 Z 表示的平均反应速率为 0.01mol·L﹣1·min﹣1,则 n是
A.1 B.4 C.2 D.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂。有关资料为:
①CuCl为微溶于水的白色固体,在空气中可被迅速氧化
②CuOH为难溶于水的黄色固体,易分解为红色的Cu2O
③Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化为蓝色
I. 甲小组同学用如下装置电解食盐水,并对电解产物进行研究。
实验装置 | 电解质溶液 | 实验现象 | |
| 5mol/L NaCl溶液 | a极附近 | b极附近 |
开始时,产生白色浑浊并逐渐增加,当沉入U型管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
(1)若a极附近生成的白色浑浊是CuCl,则铜丝a应与电源的________极相连,铜丝a的电极反应式是____。
(2)b极附近溶液的pH_________(填“增大”、“减小”或“不变”)。
(3)橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是_____________(用方程式表示)。
(4)a极附近沉淀自下而上变为橙黄色原因是____________。
II. 乙小组同学通过以下方案制取CuCl并对其组成进行研究。
将Na2SO3的水溶液逐滴加入CuCl2的水溶液中,再加入少量浓盐酸调节到pH=3左右,即可得到白色沉淀CuCl。
(1)写出产生CuCl的离子方程式______________。
(2)为了提高CuCl的产率,可采用________法快速过滤,生产过程中调节溶液的pH不能过大的原因是___。
(3)为探究白色沉淀的化学组成,将制得的白色沉淀溶于浓氨水,得到无色溶液,将无色溶液分成两份,一份放置于空气中,一段时间后溶液变为蓝色;另一份的实验方法及现象为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取并收集氯气的装置如下图所示.请回答下列问题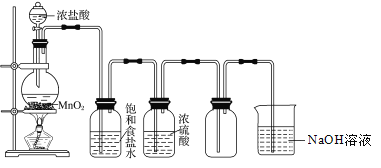
(1)气体发生装置中进行的反应化学方程式是______
(2)当0.5mol MnO2参与反应时,被氧化的HCl的质量为 ______ ,生成的Cl2在标准状况下的体积约为 ______ .
(3)在装置中:①饱和食盐水的作用是 ______ ,②浓硫酸的作用是 ______ .
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸.如果有Cl2产生,可观察到的现象是______ .
(5)写出尾气吸收装置中进行的反应的离子方程式______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有取之不尽的化学资源,从海水中可提取多种化工原料,下图是某化工厂对海水资源综合利用的示意图:

试回答下列问题:
(1)实验室里将粗盐制成精盐的过程中,过滤的操作需用到玻璃棒,玻璃棒的作用是:____,还需要的玻璃仪器有:____。
(2)粗盐中含有Ca2+、 Mg2+、 SO42-等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中:①加入过量的BaC12溶液,②过量的NaOH溶液,③过量的Na2C03溶液,则添加试剂顺序为____(填写序号),最后在滤液加入盐酸至溶液呈中性。请写出加入盐酸后可能发生反应的离子方程式:____。
(3)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子。从离子反应的角度考虑,在母液里加入石灰乳发生反应的离子方程式:____。
(4)电解无水氯化镁制取镁的化学方程式为____。将镁蒸气冷却后即为固体镁,镁蒸气需在Ar气氛围中冷却,理由:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.10g镁铝合金加入120mL4.0mol·L-1的盐酸中,待合金完全溶解后,得到溶液X。下列说法一定正确的是 ( )
A.合金完全溶解后产生的H2的物质的量为0.24mol
B.合金中的镁与铝的物质的量之比小于1
C.若向溶液X中加入270mL2.0mol·L-1NaOH溶液,充分反应,所得沉淀为Mg(OH)2
D.若向溶液X中加入足量的氨水,充分反应,所得沉淀经过过滤、洗涤后充分灼烧,则残留固体质量大于8.50g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 碳酸氢铵溶液与足量氢氧化钠溶液混合后加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B. 将少量氯化铁溶液滴入硫化钠溶液中:2Fe3++S2-=2Fe2++S↓
C. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H+ + NO3-=3Fe3++2H2O+NO↑
D. 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一元中强酸,具有较强还原性,下列有关说法正确的是( )
A. 次磷酸的电离方程式为:H3PO2=H++H2PO2-
B. NaH2PO2是次磷酸的正盐,其水溶液呈中性
C. 白磷与氢氧化钠溶液反应可得次磷酸盐,反应的化学方程式为:
P4+9NaOH=3Na2PO2+PH3↑+3H2O
D. 利用(H3PO2)进行化学镀银反应中,1mol H3PO2最多还原4mol Ag+离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com