
【题目】硅是带来人类文明的重要元素之一.下列物质中主要成分是硅酸盐的是( )
A.青花瓷
B.金刚石
C.光导纤维
D.大理石
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 用乙烷和氯气等物质的量混合可以得到纯净的氯乙烷
B. 石油裂解气不能使溴的四氯化碳溶液、酸性KMnO4溶液褪色
C. 水煤气可用来合成液态烃及甲醇等含氧有机物
D. 苯与氯气在光照的条件下通过取代反制得氯苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行实验研究(图中a、b、c表示止水夹),请对其方案进行完善或评价。
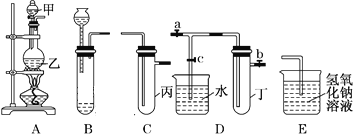
(1)实验室用装置A来制取Cl2,反应的离子方程式是______________;若将装置B、C、E相连后,用浓盐酸和______(填下列试剂的标号)为原料可制取Cl2。
a.KMnO4固体 b.KClO3固体 c.KCl固体 d.浓硫酸
(2)用装置B来制取制取氯气,并将装置B、C、E相连,在丙中加入适量水,即可制得氯水。向该氯水中加入大理石,充分振荡,观察到氯水的黄绿色逐渐褪去,同时产生少量气泡。某同学根据此现象推断出氯水呈酸性,请问该同学的推断是否合理?______________(填“合理”或“不合理”),若不合理,请说明理由(若合理,此空无需填写):_________________。
(3)为了探究氯水与大理石的反应,用装置A来制取氯气,并依次连接装置A、C、C、E。在第一个装置C的丙中,应加入的试剂是____________;在第二个装置C的丙中,加入适量水,即制得氯水。向制得的氯水中加入过量的大理石,反应结束后将所得溶液分成四等分,进行I、Ⅱ、Ⅲ、Ⅳ四个实验,实验操作如下,将实验现象或者实验结论填入下表:
实验序号 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 将该溶液滴在有色布条上 | 有色布条迅速褪色 | ①该溶液中含有__________ |
Ⅱ | 向该溶液中滴加碳酸钠溶液 | ②___________ | 该溶液中含有Ca2+ |
Ⅲ | 向该溶液中滴加稀盐酸 | 有无色气泡产生 | ③无色气体是____________ |
Ⅳ | 加热该溶液 | 溶液变浑浊并产生大量气体 | ④该溶液中含有__________ |
⑤通过上述实验,得出氯水和过量的大理石反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是短周期元素中金属性最强的元素。由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第______族;丙元素的名称为________,丙的原子结构示意图为__________。
(2)甲的单质与水反应的离子方程式为________________;
乙单质与丙单质加热反应的化学方程式为________________。
II.最新报道,我国科学家通过与多个国家进行科技合作,成功研发出铯(Cs)原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列。已知铯位于元素周期表中第六周期第ⅠA族,根据铯在元素周期表中的位置,推断下列内容:
(1)铯的原子核外共有_________层电子,最外层电子数为_________,铯的原子序数为________。
(2)铯单质与水剧烈反应,放出________色气体,同时使紫色石蕊试液显________色,因为________________(写出化学方程式)。
(3)预测铯单质的还原性比钠单质的还原性________(填“弱”或“强”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项与化学平衡移动原理无关的是
A.加催化剂,使N2和H2在一定的条件下转化为NH3
B.收集氯气用排饱和食盐水的方法
C.加压条件下有利于SO2和O2反应生成SO3
D.可用浓氨水和氢氧化钠固体快速制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把 0.6molX气体和0.4molY气体混合于2L的密闭容器中,使它们发生如下反应3X(g) + Y(g) ![]() nZ(g)+2W(g),5min末已生成 0.2molW,若测知以 Z 表示的平均反应速率为 0.01mol·L﹣1·min﹣1,则 n是
nZ(g)+2W(g),5min末已生成 0.2molW,若测知以 Z 表示的平均反应速率为 0.01mol·L﹣1·min﹣1,则 n是
A.1 B.4 C.2 D.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂。有关资料为:
①CuCl为微溶于水的白色固体,在空气中可被迅速氧化
②CuOH为难溶于水的黄色固体,易分解为红色的Cu2O
③Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化为蓝色
I. 甲小组同学用如下装置电解食盐水,并对电解产物进行研究。
实验装置 | 电解质溶液 | 实验现象 | |
| 5mol/L NaCl溶液 | a极附近 | b极附近 |
开始时,产生白色浑浊并逐渐增加,当沉入U型管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
(1)若a极附近生成的白色浑浊是CuCl,则铜丝a应与电源的________极相连,铜丝a的电极反应式是____。
(2)b极附近溶液的pH_________(填“增大”、“减小”或“不变”)。
(3)橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是_____________(用方程式表示)。
(4)a极附近沉淀自下而上变为橙黄色原因是____________。
II. 乙小组同学通过以下方案制取CuCl并对其组成进行研究。
将Na2SO3的水溶液逐滴加入CuCl2的水溶液中,再加入少量浓盐酸调节到pH=3左右,即可得到白色沉淀CuCl。
(1)写出产生CuCl的离子方程式______________。
(2)为了提高CuCl的产率,可采用________法快速过滤,生产过程中调节溶液的pH不能过大的原因是___。
(3)为探究白色沉淀的化学组成,将制得的白色沉淀溶于浓氨水,得到无色溶液,将无色溶液分成两份,一份放置于空气中,一段时间后溶液变为蓝色;另一份的实验方法及现象为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com