
【题目】I.甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是短周期元素中金属性最强的元素。由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第______族;丙元素的名称为________,丙的原子结构示意图为__________。
(2)甲的单质与水反应的离子方程式为________________;
乙单质与丙单质加热反应的化学方程式为________________。
II.最新报道,我国科学家通过与多个国家进行科技合作,成功研发出铯(Cs)原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列。已知铯位于元素周期表中第六周期第ⅠA族,根据铯在元素周期表中的位置,推断下列内容:
(1)铯的原子核外共有_________层电子,最外层电子数为_________,铯的原子序数为________。
(2)铯单质与水剧烈反应,放出________色气体,同时使紫色石蕊试液显________色,因为________________(写出化学方程式)。
(3)预测铯单质的还原性比钠单质的还原性________(填“弱”或“强”)。
【答案】 四 ⅥA 钠 略 2K+2H2O===2K++2OH-+H2↑ 2Na+O2Na2O2 6 1 55 无 蓝 2Cs+2H2O===2CsOH+H2↑ 强
【解析】I.甲元素的原子序数是19,因此甲是K;乙元素原子核外有两个电子层,最外电子层上有6个电子,所以乙是O;丙是短周期元素中金属性最强的元素,则丙是Na。
(1)K元素在周期表中位于第四周期;氧元素在周期表中位于第ⅥA族;丙元素的名称钠,Na的原子结构示意图为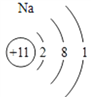 。(2)甲的单质与水反应的离子方程式为2K+2H2O=2K++2OH-+H2↑;乙单质与丙单质加热反应的化学方程式为2Na+O2
。(2)甲的单质与水反应的离子方程式为2K+2H2O=2K++2OH-+H2↑;乙单质与丙单质加热反应的化学方程式为2Na+O2![]() Na2O2。
Na2O2。
II.(1)已知铯位于元素周期表中第六周期第ⅠA族,所以铯的原子核外共有6层电子,最外层电子数为1,铯的原子序数为55。(2)铯单质与水剧烈反应,放出无色色气体氢气,同时生成强碱氢氧化铯,使紫色石蕊试液显蓝色,反应的化学方程式为2Cs+2H2O=2CsOH+H2↑。(3)同主族自上而下金属性逐渐增强,则铯单质的还原性比钠单质的还原性强。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1 molL-1 AlCl3溶液中含有的Al3+数目小于NA
B. 标准状况下,11 g![]() H2
H2![]() O中含有的质子数目为6NA
O中含有的质子数目为6NA
C. 1 mol Li2O和Na2O2的混合物中含有的离子总数大于3NA
D. 常温常压下,4.6 g NO2所含的氮原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯在医药工业中可作为有机合成的中间体,其中一种合成路线如下:

已知:①烃A是最简单的烯烃
②醛与醛能在一定条件下反应,原理如下:

回答下列问题:
(1)烃A的结构简式为____________。
(2)反应③的试剂和反应条件为___________;反应⑩的试剂和反应条件为______________;反应⑧的反应试剂______________(填“能”或“不能”)改用酸性高锰酸钾溶液,其原因是___________________。
(3)反应⑦的反应类型为______。
(4)H与银氨溶液反应的化学方程式为______________________。
(5)符合下列条件的I的同分异构体共有______种。
①除苯环外不含有其他环状结构;②能发生水解反应和银镜反应。
其中核磁共振氢谱显示为5组峰,且峰面积比为1:1:2:2:2的是______(写结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为四种短周期元素,其中A、B、D为相邻的同周期元素, B、C同主族,且B、C可形成共价化合物BC3 和BC2 ,A的原子结构示意图如右图所示。据此填空:

(1)A的元素名称为________,其气态氢化物的化学式为____________。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为____________________(填元素符号)。
(3)B和D最高价氧化物的水化物化学式分别为____________和____________。
(4)上述四种元素形成的氢化物中沸点最高的是_______(填化学式),原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016上海卷】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]
B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-]
D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。_______________________
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015四川卷】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是( )
A.550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里保存下列试剂的方法,有错误的是
A. 新制氯水盛放在棕色试剂瓶中,存放于低温避光的地方
B. 碘易升华,盛放在有水的棕色广口试剂瓶中
C. 液溴易挥发,盛放在用水液封的棕色试剂瓶中
D. 浓盐酸易挥发,盛装在无色密封的细口玻璃试剂瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com