
【题目】已知A、B、C、D为四种短周期元素,其中A、B、D为相邻的同周期元素, B、C同主族,且B、C可形成共价化合物BC3 和BC2 ,A的原子结构示意图如右图所示。据此填空:

(1)A的元素名称为________,其气态氢化物的化学式为____________。
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为____________________(填元素符号)。
(3)B和D最高价氧化物的水化物化学式分别为____________和____________。
(4)上述四种元素形成的氢化物中沸点最高的是_______(填化学式),原因是________________。
【答案】 硅 SiH4 O S P Si H2SO4 H3PO4 H2O 水分子间能形成氢键。
【解析】本题考查核外电子排布规律、熔沸点高低判断、半径大小比较,(1)根据核外电子排布规律,K层最多容纳2个电子,即x=2,y=14,则A为Si,名称为硅,其气态氢化物是SiH4;(2)B和C同主族,且形成共价化合物BC3和BC2,即B为S,C为O,A、B、D为相邻的同周期元素,即D为P,电子层越多半径越大,电子层相同,半径随着原子序数的递增而减小,即原子半径大小顺序是:O<S<P<Si;(3)根据(1)和(2)的分析,形成最高价氧化物的水化物是H2SO4、H3PO4;(4)形成的氢化物分别是SiH4、H2S、H2O、PH3,常温下H2O是液体,且H2O分子间形成分子间氢键,含有分子间氢键的物质熔沸点高。


科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、R的化合价与原子序数的关系如下图所示.下列说法不正确的是( )
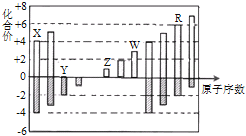
A. X、Y都存在同素异形现象
B. 工业上常用W的氧化物为原料制取单质W
C. Z和Y形成的化合物中只存在离子键
D. 常温下单质W不能溶于R的最高价氧化物对应水化物的浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是
A. 硝酸钠、氢氧化钠
B. 氧化铜、二氧化锰
C. 氯化钾、二氧化锰
D. 硫酸铜、氢氧化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行实验研究(图中a、b、c表示止水夹),请对其方案进行完善或评价。
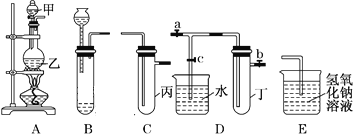
(1)实验室用装置A来制取Cl2,反应的离子方程式是______________;若将装置B、C、E相连后,用浓盐酸和______(填下列试剂的标号)为原料可制取Cl2。
a.KMnO4固体 b.KClO3固体 c.KCl固体 d.浓硫酸
(2)用装置B来制取制取氯气,并将装置B、C、E相连,在丙中加入适量水,即可制得氯水。向该氯水中加入大理石,充分振荡,观察到氯水的黄绿色逐渐褪去,同时产生少量气泡。某同学根据此现象推断出氯水呈酸性,请问该同学的推断是否合理?______________(填“合理”或“不合理”),若不合理,请说明理由(若合理,此空无需填写):_________________。
(3)为了探究氯水与大理石的反应,用装置A来制取氯气,并依次连接装置A、C、C、E。在第一个装置C的丙中,应加入的试剂是____________;在第二个装置C的丙中,加入适量水,即制得氯水。向制得的氯水中加入过量的大理石,反应结束后将所得溶液分成四等分,进行I、Ⅱ、Ⅲ、Ⅳ四个实验,实验操作如下,将实验现象或者实验结论填入下表:
实验序号 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 将该溶液滴在有色布条上 | 有色布条迅速褪色 | ①该溶液中含有__________ |
Ⅱ | 向该溶液中滴加碳酸钠溶液 | ②___________ | 该溶液中含有Ca2+ |
Ⅲ | 向该溶液中滴加稀盐酸 | 有无色气泡产生 | ③无色气体是____________ |
Ⅳ | 加热该溶液 | 溶液变浑浊并产生大量气体 | ④该溶液中含有__________ |
⑤通过上述实验,得出氯水和过量的大理石反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子键、共价键的叙述中正确的是( )
A.非极性键只存在于双原子的单质分子(如Cl2)中
B.在共价化合物里,可能存在离子键
C.在离子化合物里,只存在离子键,没有共价键
D.化学反应的实质是旧键的断裂,新键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是短周期元素中金属性最强的元素。由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第______族;丙元素的名称为________,丙的原子结构示意图为__________。
(2)甲的单质与水反应的离子方程式为________________;
乙单质与丙单质加热反应的化学方程式为________________。
II.最新报道,我国科学家通过与多个国家进行科技合作,成功研发出铯(Cs)原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列。已知铯位于元素周期表中第六周期第ⅠA族,根据铯在元素周期表中的位置,推断下列内容:
(1)铯的原子核外共有_________层电子,最外层电子数为_________,铯的原子序数为________。
(2)铯单质与水剧烈反应,放出________色气体,同时使紫色石蕊试液显________色,因为________________(写出化学方程式)。
(3)预测铯单质的还原性比钠单质的还原性________(填“弱”或“强”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列五种有色溶液与SO2作用均能褪色,其实质相同的是( ) ①品红溶液;②酸性KMnO4溶液;③溴水;④滴有酚酞的NaOH溶液;⑤含I2的淀粉溶液.
A.①④
B.①②③
C.②③⑤
D.③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com