
【题目】N2O和CO是环境污染性气体,可在催化条件下转化为无害气体,反应进程中的能量变化如图所示。下列说法正确的是

A. 加入催化剂使反应的△H变小
B. 该反应的热化学方程式为:N2O(g)+CO(g)===CO2(g)+N2(g) △H= - 226 kJ·mol-1
C. 反应物的总键能大于生成物的总键能
D. 该反应正反应的活化能大于逆反应的活化能
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
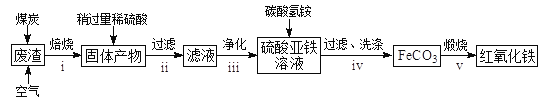
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5mol/L,则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入适量氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。这一过程的总反应的离子方程式______。
(4)古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,正确的一组是( )
①淀粉、油脂在一定条件下都能发生水解反应 ②淀粉和纤维素互为同分异构体
③食用油属于酯类,石蜡油属于烃类 ④石油的分馏和煤的气化都发生了化学变化
⑤淀粉遇碘酒变蓝色,在加热条件下葡萄糖能与新制Cu(OH)2悬浊液发生反应
A. ①②⑤B. ①②④C. ①③⑤D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于胶体的叙述中,不正确的是
A. 向胶体中加蔗糖溶液,产生聚沉现象
B. 可见光透过胶体时,发生丁达尔现象
C. 用渗析的方法“净化”胶体时,使用的半透膜只能让小分子、离子通过
D. 胶体微粒能吸附阳离子或阴离子,故在电场作用下产生电泳现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷烃可以由相应的烯烃经催化加氢得到,有一种烷烃A,分子式为C9H20,它却不能由任何C9H18的烯烃催化加氢得到。而另有A的三个同分异构体B1、B2、B3,分别可以而且只能由一种相应的烯烃催化加氢得到,推断并写出A、B1、B2、B3的结构简式为:A________,B1______________,B2__________,B3_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Bilirubin在一定波长光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应48min平均反应速率和推测反应16min时反应物的浓度,结果应是( )
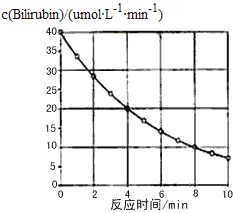
A. 2.5μmol/(L·min)和 2.0μmolB. 2.5μmol/(L·min)和 2.5μmol
C. 3.0μmol/(L·min)和 3.0μmolD. 5.0μmol/(L·min)和 3.0μmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)在工业上可用于制造铁盐、氧化铁红及靛青等。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

25℃ | pH值 |
饱和H2S溶液 | 3.9 |
SnS沉淀完全 | 1.6 |
FeS开始沉淀 | 3.0 |
FeS开始沉淀 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为________。
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液 D.苯酚溶液
(2)操作Ⅱ中,通入硫化氢至饱和的目的是______________________________________;在溶液中用硫酸酸化至pH=2的目的是__________________________________。
(3)操作Ⅳ的顺序依次为_________________、冷却结晶、____________________。
(4)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_________________________________________________________。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.850 g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①滴定时盛放KMnO4溶液的仪器为________________________(填仪器名称)。
②计算上述样品中FeSO4·7H2O的质量分数为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com