
| A.等物质的量Na2FeO4氧化能力优于次氯酸钠 |
| B.湿法中氢氧化铁被氧化 |
| C.干法中每生成1 mol Na2FeO4转移3 mol电子 |
| D.高铁酸钠的氧化性大于次氯酸钠 |
科目:高中化学 来源:不详 题型:单选题
| A.向浓度都为0.1mol·L-1Na2CO3和NaOH混合溶液中通入CO2,NaOH首先反应 |
| B.向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+首先反应 |
| C.向浓度都为0.1mol·L-1的FeCl3和CuCl2混合溶液中加入铁粉,CuCl2首先反应 |
| D.向0.1mol·L-1的FeCl3溶液中加入质量相同、颗粒大小相同的铁和铜,铜首先反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 KCl+3K2MnO4+3H2O。下列有关说法中正确的是 ( )。
KCl+3K2MnO4+3H2O。下列有关说法中正确的是 ( )。| A.KOH和KCl中均含有共价键 |
| B.MnO2在反应中被还原 |
| C.K2MnO4的氧化性大于KClO3 |
| D.该反应中,每生成3 mol K2MnO4转移的电子数为6×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O Cu(NO3)2
Cu(NO3)2 CuO
CuO Cu(NO3)2
Cu(NO3)2 CuO
CuO Cu(OH)2
Cu(OH)2 Cu(NO3)2
Cu(NO3)2  CuSO4
CuSO4 Cu(NO3)2
Cu(NO3)2查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | 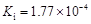 |  |  |  |
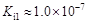 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O ,试配平上述化学方程式。
,试配平上述化学方程式。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 KCl + MnCl2 + Cl2↑ + H2O
KCl + MnCl2 + Cl2↑ + H2O | A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.非金属元素(稀有气体元素除外)都是主族元素,单质在反应中都只能作氧化剂 |
| B.常温下,1 mol氯气和足量稀NaOH溶液完全反应转移1mol电子 |
| C.在加热条件下,用乙醇除去乙酸乙酯中的乙酸 |
| D.硫酸铜溶液显酸性的原因:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com