
科目:高中化学 来源: 题型:阅读理解
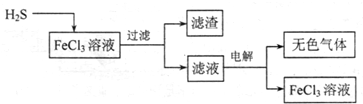
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源:设计必修一化学鲁科版 鲁科版 题型:022
实验室里研究不同价态硫元素间的转化
1.二氧化硫(SO2)
(1)物理性质:通常情况下,二氧化硫________色,有________气味,比空气________,有________性,________溶于水.标准状况下,1体积水能溶解________体积二氧化硫.
(2)化学性质:二氧化硫中硫元素为+4价(中间价态),所以二氧化硫既有________又有________,二氧化硫是酸性氧化物,是________的酸酐.
①氧化性:SO2+2H2S![]() ________
________
②还原性:2SO2+O2![]() ________
________
SO2+Cl2+2H2O![]() ________
________
③酸性氧化物:与H2O、NaOH、Ca(OH)2等物质反应.
SO2+H2O![]() ________
________
④漂白性
可以使品红或其他有色物质褪色.原理是:二氧化硫能与某些有色物质化合生成不稳定的无色物质.这种无色物质受热或光照时易分解,放出SO2,恢复原来的颜色.
2.硫酸(H2SO4)
(1)物理性质:纯硫酸是________色、黏稠、________状液体,沸点________、难挥发.常用的浓硫酸质量分数是________,密度比水________.硫酸溶于水时放出大量的热.
②脱水性
浓硫酸能从一些有机物中将氢、氧两元素按H2O的组成(H∶O=2∶1)脱去.
例如:浓硫酸能使火柴棒、纸张变黑,就体现了其脱水性.
③强氧化性
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2H2SO4(浓)+C![]() ________.
________.
常温下,冷的浓H2SO4能使Fe和Al的表面形成一层________保护膜,阻止了内部金属与H2SO4反应.这种现象叫钝化.
总结:不同价态硫元素间的相互转化
0→-2:Fe+S![]() FeS,H2+S
FeS,H2+S![]() H2S……
H2S……
0→+4:S+O2![]() SO2,S+2H2SO4(浓)
SO2,S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
0→+6:S+6HNO3(浓)![]() H2SO4+6NO2↑+2H2O
H2SO4+6NO2↑+2H2O
-20:2H2S+SO2![]() 2H2O+3S↓,H2S+Cl2
2H2O+3S↓,H2S+Cl2![]() 2HCl+S↓……
2HCl+S↓……
-2→+4:H2S+3H2SO4(浓)![]() 4SO2+4H2O
4SO2+4H2O
-2→+6:H2S+8HNO3(浓)![]() H2SO4+8NO2+4H2O
H2SO4+8NO2+4H2O
+4→0:2H2S+SO2![]() 2H2O+3S↓
2H2O+3S↓
+4→+6:2SO2+O2![]() ________……
________……
+6→+4:Cu+2H2SO4(浓)![]() ________
________
查看答案和解析>>
科目:高中化学 来源: 题型:
(9分)A、B、C、D是中学化学中常见的四种化合物,它们分别由两种元素组成.甲、乙、丙是单质,甲、丙、A、C、D常温下均为气体,B为液体.这些单质和化合物之间存在如下关系:
(1)写出下列物质的分子式:A_______ 甲_______、丙_______.
(2)写出单质甲跟化合物C反应,生成SO2和化合物B的化学方程式_____________.
(3)标准状况下将28L化合物A与足量的过氧化钠充分反应转移电子的数目为
(4)在密闭容器中,化合物B跟化合物D在高温下生成化合物A和单质丙的反应是可逆反应,其化学方程式为__________。
(5)化合物C的稳定性比化合物B (填强或弱)。
【解析】本题属于无机框图题,关键是寻找突破点。常见的液体是水,则B是水。单质和化合物反应生成SO2和水的反应,根据原子守恒可知甲应是氧气,C是H2S。单质和气态化合物反应生成另外一种气态化合物的,常见的是CO2和C的反应生成CO,因此A是CO2,D是CO,乙是C。CO在高温下和水蒸气反应又生成CO2和氢气,所以丙是氢气。
(1)(2)(4)略
(3)28LCO2的物质的量是![]() 。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。
。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。
(5)S的非金属性弱于O的,所以H2S的稳定性弱于H2O的。
查看答案和解析>>
科目:高中化学 来源:2011-2012年黑龙江大庆铁人中学高一下学期第一次阶段检测化学试卷(解析版) 题型:填空题
(9分)A、B、C、D是中学化学中常见的四种化合物,它们分别由两种元素组成.甲、乙、丙是单质,甲、丙、A、C、D常温下均为气体,B为液体.这些单质和化合物之间存在如下关系:
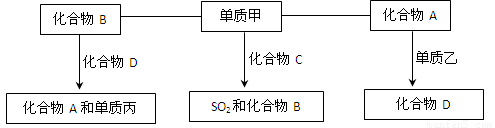
(1)写出下列物质的分子式:A_______ 甲_______、丙_______.
(2)写出单质甲跟化合物C反应,生成SO2和化合物B的化学方程式_____________.
(3)标准状况下将28L化合物A与足量的过氧化钠充分反应转移电子的数目为
(4)在密闭容器中,化合物B跟化合物D在高温下生成化合物A和单质丙的反应是可逆反应,其化学方程式为__________。
(5)化合物C的稳定性比化合物B (填强或弱)。
【解析】本题属于无机框图题,关键是寻找突破点。常见的液体是水,则B是水。单质和化合物反应生成SO2和水的反应,根据原子守恒可知甲应是氧气,C是H2S。单质和气态化合物反应生成另外一种气态化合物的,常见的是CO2和C的反应生成CO,因此A是CO2,D是CO,乙是C。CO在高温下和水蒸气反应又生成CO2和氢气,所以丙是氢气。
(1)(2)(4)略
(3)28LCO2的物质的量是 。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。
。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。
(5)S的非金属性弱于O的,所以H2S的稳定性弱于H2O的。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com