
【题目】(1)科研人员设想用如图所示装置生产硫酸。
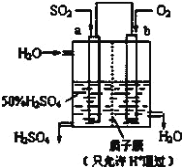
①上述生产硫酸的总反应方程式为_____,b 是_____极,b 电极反应式为______________,生产过程中H+向_____(填 a 或 b)电极区域运动。
②该小组同学反思原电池的原理,其中观点正确的是_____(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原申池装置一定需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
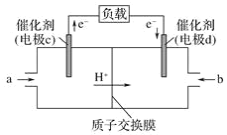
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜(只允许H+通过)质子交换膜左右两侧的溶液均为1L 2mol·L-1H2SO4溶液。燃料电池的结构示意图如:电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为_____(填“正极”或“负极”),c电极反应方程式为___________________________。当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。
【答案】2SO2+O2+2H2O=2H2SO4 正 O2+4e-+4H+=2H2O b D 负极 CH3OH-6e-+H2O=CO2+6H+ 12g
【解析】
(1)原电池中负极失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此判断;
(2)根据电子的移动方向判断正负极,进而书写电极反应式。
(1)①根据装置图可知a电极通入二氧化硫,二氧化硫发生失去电子的氧化反应,氧气在正极通入,因此上述生产硫酸的总反应方程式为2SO2+O2+2H2O=2H2SO4,b通入氧气,是正极,氧气在酸性条件下得电子产生水,反应式为O2+4e-+4H+=2H2O,原电池中阳离子向正极移动,则生产过程中H+向b电极区域运动;
②A.原电池反应的过程中一定有电子发生转移,选项A错误;
B.原申池装置不一定需要2个活泼性不同的金属电极,例如燃料电池等,选项B错误;
C.原电池中电极可以参加反应,例如铜、锌、稀硫酸组成的原电池中锌电极参加反应,选项C错误;
D.原电池中氧化反应和还原反应可以拆开在两极发生,选项D正确;
答案选D;
(2)根据装置图可知电子从c电极流出,则c电极是负极,电池总反应为2CH3OH+3O2=2CO2+4H2O,所以甲醇在负极发生失去电子的氧化反应转化为二氧化碳,则c电极反应方程式为CH3OH-6e-+H2O=CO2+6H+;
负极反应式为CH3OH-6e-+H2O=CO2+6H+,当转移1mol电子时,左侧质量减轻![]() ×12g=2g,还要有1molH+通过质子交换膜进入右侧,质量减少1g,正极反应式为O2+4H++4e-=2H2O,右侧质量增加32g×
×12g=2g,还要有1molH+通过质子交换膜进入右侧,质量减少1g,正极反应式为O2+4H++4e-=2H2O,右侧质量增加32g×![]() =8g,加上转移过来的1gH+,因此左右两侧溶液的质量之差为8g+1g+2g+1g=12g。
=8g,加上转移过来的1gH+,因此左右两侧溶液的质量之差为8g+1g+2g+1g=12g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A.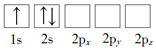 B.
B.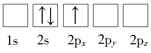
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
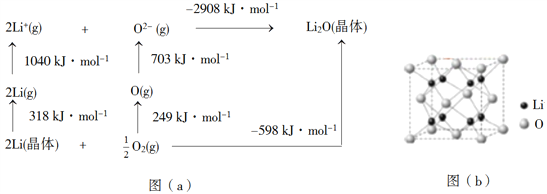
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构简式为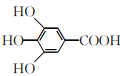 ,下列关于没食子酸的说法正确的是
,下列关于没食子酸的说法正确的是
A. 分子式为C7H7O5
B. 能发生加成反应,消去反应和取代反应
C. 1 mol没食子酸与足量的碳酸氢钠反应,生成4 mol CO2
D. 1 mol没食子酸与足量的钠反应,生成2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示。以下有关该物质的说法中不正确的是( )
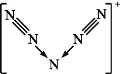
A. 每个N5+中含有35个质子和34个电子
B. 该离子中有非极性键和配位键
C. 该离子中含有4个π键
D. 与PCl4+互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时,正逆反应速率为零
B. 若单位时间内生成xmol NO的同时,生成xmol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2υ(NH3)=3υ(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置或操作正确且能达到实验目的的是
A.制备氢氧化亚铁 | B.石油的蒸馏 | C.分离苯和水 | D.比较Fe、Cu的金属活动性 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g) ![]() pC(g)+qD(g),当m、n、p、q为任意整数时,下列说法一定能说明反应已达到平衡的是
pC(g)+qD(g),当m、n、p、q为任意整数时,下列说法一定能说明反应已达到平衡的是
①体系的压强不再改变 ②体系的温度不再改变③各组分的浓度不再改变 ④各组分的质量分数不再改变⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A. ③④⑤⑥B. ②③④⑥C. ①③④⑤D. ①③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com