
【题目】常温下,下列各组离子在指定的溶液中一定能大量共存的是
A. 能溶解![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B. 水电离出![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C. 滴入KSCN显红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
D. ![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
【答案】C
【解析】
A、能溶解Al2O3的溶液为强酸或强碱溶液;
B、水电离出的c(H+)═10-9mol/L的溶液为酸性或碱性溶液;
C、滴入KSCN显红色的溶液中含有Fe3+离子;
D、c(H+)/c(OH-)=1012的溶液为酸性溶液。
A项、能溶解Al2O3的溶液,为强酸或强碱溶液,HCO3-既能与酸反应又能与碱反应,在能溶解![]() 的溶液中不能共存;从溶液中的离子可知,AlO2—、HCO3-与Fe3+相发生双水解,在溶液中不能共存,故A错误;
的溶液中不能共存;从溶液中的离子可知,AlO2—、HCO3-与Fe3+相发生双水解,在溶液中不能共存,故A错误;
B项、水电离出的c(H+)═10-9mol/L的溶液为酸性或碱性溶液, 碱性溶液中,Fe3+与OH—反应不能大量存在,故B错误;
C项、滴入KSCN显红色的溶液中含有Fe3+离子,溶液中离子之间都不发生任何反应,也不与Fe3+离子反应,可大量共存,故C正确;
D项、c(H+)/c(OH-)=1012的溶液为酸性溶液,HCO3-能与酸反应不能大量存在,故D错误。
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将8.4g Fe投入浓硝酸中,产生红棕色气体A,把所得溶液减压蒸干,得到30g Fe(NO3)2和Fe(NO3)3的混合物,将该固体隔绝空气在高温下加热,得到红棕色的Fe2O3和气体B,A、B气体混合通入足量水中得到硝酸和NO,在标准状况生成NO气体的体积为
A. 1120mL B. 2240mL C. 3360mL D. 4480mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的资源,如下图所示利用海水可获得许多化工产品。
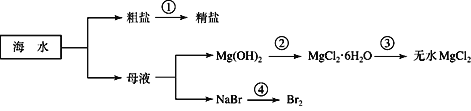
下列有关说法正确的是
A. 第①步中除去粗盐中的Ca2+、Mg2+、SO42-等杂质,加入的试剂顺序为:Na2CO3溶液、NaOH溶液、BaCl2溶液,过滤后加盐酸
B. 第②步是将氢氧化镁与盐酸反应,然后加热蒸干溶液得到晶体
C. 第③步中的反应需在氯化氢气流中进行
D. 第④步中溴元素被还原出来后用四氯化碳萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得到各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性强于浓硫酸,能漂白某些有机染料,如品红等。回答下列问题:
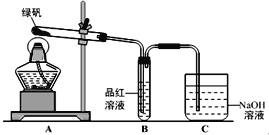
(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置C的作用是_______________。装置B中可观察到的现象是__________________________,甲组同学由此得出绿矾的分解产物中含有SO2。
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中______(填字母)。
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解所得气态产物的装置:
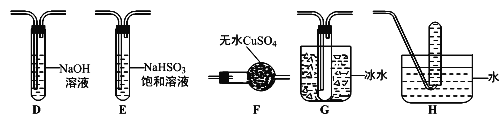
①丙组同学的实验装置中,依次连接的合理顺序为A→_________________→H。
②能证明绿矾分解产物中有O2的检验方法是________________________。
(4)为证明绿矾分解产物中含有三价铁的操作及现象__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法错误的是
A.除去KCl中混有的KI:溶于水通入过量氯气,蒸发结晶
B.除去BaSO4固体中混有的BaCO3:加过量盐酸后,过滤
C.除去Na2CO3固体中的NaHCO3:加热至恒重
D.除去CO2中混有的HCl:将气体通过饱和Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
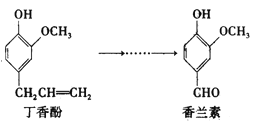
有关上述两种化合物的说法正确的是
A. 丁香酚的分子式为:C10H12O2
B. 可以用FeCl3溶液鉴别丁香酚和香兰素
C. 常温下,1mol丁香酚只能与2molBr2反应
D. 香兰素分子可与Na2CO3溶液反应生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化学反应和事实,说明反应利用了硫酸的什么性质,将表示性质的选项的字母填在各小题的横线上.
A.不挥发性 B.酸性 C.吸水性 D.脱水性 E.强氧化性 F 强酸性
(1)浓硫酸可作气体干燥剂___________________
(2)蔗糖中加浓![]() 产生“黑面包”现象__________________
产生“黑面包”现象__________________
(3)![]() (稀)=
(稀)=![]() _________________
_________________
(4)![]() _________________
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是( )
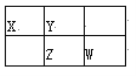
A. Z元素位于周期表的第三周期第VA族
B. X、W元素的最高价氧化物对应水化物的酸性:W强于X
C. Y元素的气态氢化物的热稳定性比Z的高
D. X与W形成共价化合物XW2, X的原子半径比Y小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料。已知0.4 mol N2H4(l)和足量H2O2(l)反应,生成氮气和水蒸气,放出256.65 kJ的热量。写出该反应的热化学方程式_______________。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时,正极的反应式是_________________________________、负极的反应式是____________________________________。
(2)在一密闭容器中充入1 mol H2和1 mol I2,压强为P(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)=2HI(g) △H<0。试回答:若升高起始时的反应温度,反应速率将___________(填“增大”、“减小”或“不变”,下同);若将容器的容积缩小一半,反应速率将___________;若保持容器的容积不变,向其中加入1 mol N2(N2不参加反应),反应速率将__________;若保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率将____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com