
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是( )
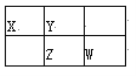
A. Z元素位于周期表的第三周期第VA族
B. X、W元素的最高价氧化物对应水化物的酸性:W强于X
C. Y元素的气态氢化物的热稳定性比Z的高
D. X与W形成共价化合物XW2, X的原子半径比Y小
【答案】D
【解析】
根据Z的最外层电子数是内层电子总数的1/2,推出Z为P,根据元素周期表的结构,推出X为C,Y为N,W为S,然后进行分析。
根据元素周期表的结构,Z位于第三周期,Z的最外层电子数是内层电子总数的1/2,则Z为P,根据在周期表的位置,X为C,Y为N,W为S,
A、Z为P,位于第五周期VA族,故A说法正确;
B、C的最高价氧化物对应水化物为H2CO3为弱酸,S的最高价氧化物对应水化物为H2SO4,属于强酸,即H2SO4的酸性强于H2CO3,故B说法正确;
C、Y的氢化物为NH3,Z的氢化物为PH3,N的非金属性强于P,则NH3的稳定性高于PH3,故C说法正确;
D、形成化合物是CS2,为共价化合物,同周期从左向右原子半径减小,即C的原子半径大于N,故D说法错误。


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】某同学在探究废干电池内的黑色固体回收利用时,进行了如图所示实验:

查阅教材可知,普通锌锰干电池中的黑色物质的主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作②的名称是_____。
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、_____、_____和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为_____。
(3)操作④的试管中加入操作③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色滤渣中含有_____。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
实验目的 | 实验操作 | 实验现象 | 实验结论 |
①检验Cl- | 加入硝酸酸化的硝酸银溶液 | 有白色沉淀产生 | 含有Cl- |
②检验NH4+ | 取少许滤液于试管中, ____ | _____ | 含有NH4+ |
③检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入稀氨水,沉淀又溶解 | 含有Zn2+ |
(5)根据以上实验报告,关于滤液的成分,该同学的结论是滤液中含有NH4Cl和ZnCl2。若想从滤液中得到溶质固体,还应进行的操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定的溶液中一定能大量共存的是
A. 能溶解![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B. 水电离出![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C. 滴入KSCN显红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
D. ![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在天平的左右两个托盘上放有两个烧杯,两个烧杯中分别盛有盐酸和氢氧化钠溶液,天平处于平衡状态,当分别向两烧杯中加入等质量的铝(酸和碱都是足量的)充分反应后
A. 天平保持平衡 B. 左高右低 C. 左低右高 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原料从杨树中提取,现可用如下反应制备:

下列叙述错误的是
A. X、Y和Z均能使溴水褪色,且原理相同
B. X和Z均能与Na2CO3溶液反应放出CO2
C. Z中含手性碳原子
D. Y可作加聚反应的单体,X可作缩聚反应的单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大且小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的3倍,Z与Y同族,Q原子基态时3p原子轨道上有1个未成对的电子,W的原子序数为29。回答下列问题:
(1)X2Y2分子中Y原子轨道的杂化类型为____。
(2)化合物沸点比较:X2Y____X2Z,其原因是____。
(3)元素Z最高价氧化物对应水化物的阴离子空间构型为____,与该离子互为等电子体且含有Q元素的一种分子的分子式是____。
(4)W基态原子的核外电子排布式是____,元素W的一种氯化物晶体的晶胞结构如下图所示,该氯化物的化学式是____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-35 | 10-6 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH 至少达到____________,恰好能使Fe3+、A13+沉淀完全。(当离子浓度降到1.0×10-5mol·L-1时即视为沉淀完全)
(3)滤渣B的成分是___________________。
(4)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极电极反应式为_____________________________________________________。
(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI 溶液充分反应后,配制成100mL溶液。取其中20.00mL,恰好与25.00mL 0.0800mol·L-1Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算可得该样品纯度_____%。(小数点后保留1位数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学知识在日常生活中有很多应用,下列有关叙述正确的是
A. 用食盐易清洗热水瓶中的水垢
B. 用米汤检验含碘盐中的碘酸钾
C. 漂白粉在空气中容易变质的原因是Ca(ClO)2见光易分解
D. 利用丁达尔效应区别蛋白质溶液和食盐水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com