
����Ŀ����������������п�̸ɵ�صĻ������ϣ���ҵ�������̿����̿�Ϊԭ�����Ʊ���ij���̿���Ҫ�ɷ�ΪMnO2��������Si��16.27%����Fe��5.86%����Al��3.42%����Zn��2.68%����Cu��0.86%����Ԫ�صĻ�����䴦������ͼ���£�

������ | Al��OH��3 | Fe��OH��2 | Fe��OH��3 |
Ksp����ֵ | 10-35 | 10-6 | 10-38 |
��1���������������������½�MnO2��ԭΪMnSO4�����ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ______________________��
��2������ˮ���������������������������ܼӿ췴Ӧ���ʣ�����___________������A�ijɷ���Fe��OH��3��Al��OH��3�����백ˮ�����pH ���ٴﵽ____________��ǡ����ʹFe3+��A13+������ȫ��(������Ũ�Ƚ���1.0��10-5mol��L-1ʱ����Ϊ������ȫ)
��3������B�ijɷ���___________________��
��4��MnO2Ҳ����MnSO4-H2SO4-H2OΪ��ϵ�ĵ��Һ�е���ã��������缫��ӦʽΪ_____________________________________________________��
��5����ҵ�ϲ��ü��������ԭ�ζ����ⶨMnO2���ȣ�������������£�ȷ����0.9200g����Ʒ������������KI ��Һ��ַ�Ӧ�����Ƴ�100mL��Һ��ȡ����20.00mL��ǡ����25.00mL 0.0800mol��L-1Na2S2O3��Һ��Ӧ��I2+2S2O32-=2I-+S4O62-��������ɵø���Ʒ����_____%��(С�������1λ����)��
���𰸡� MnO2+2FeSO4+2H2SO4=MnSO4+Fe2��SO4��3+2H2O �������������Fe2+ 4 CuS��ZnS Mn2+-2e-+2H2O=MnO2+4H+ 47.3
��������
���Ȿ�������̿��Ʊ�MnO2������Ϊ���壬�������̵ķ��������ʵķ�����ᴿ���ܶȻ��ļ���ͳ�����ת�������ԭ���͵缫��Ӧʽ����д��������ԭ�ζ��ⶨ���ʵĴ��ȡ�
��1�����̿��м���H2SO4����FeSO4��Һ�������ʱMnO2����ԭΪMnSO4����FeSO4��������Fe2��SO4��3���������ʱ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ��MnO2+2FeSO4+2H2SO4=MnSO4+Fe2��SO4��3+2H2O��
��2���������ʱ����MnO2����ԭ��MnSO4����Fe��Al��Zn��CuҲ�ܽ�ת��ΪFeSO4��Al2��SO4��3��ZnSO4��CuSO4���������˵õ�����Һ�к�MnSO4��Fe2��SO4��3��FeSO4��Al2��SO4��3��ZnSO4��CuSO4�������Һ�м��백ˮ�����裬�����������������ܼӿ췴Ӧ���ʣ����ܽ�Fe2+�������ת����Fe3+�����백ˮ����pHʹAl3+��Fe3+��ȫת����Al��OH��3��Fe��OH��3�����γ�����A������Al��OH��3��Fe��OH��3������ͬ��Al��OH��3���ܶȻ�����Fe��OH��3���ܶȻ���ʹFe3+��Al3+��ȫ������ֻҪʹAl3+��ȫ��������c��Al3+��![]() 1
1![]() 10-5mol/L��c��Al3+����c3��OH-��=10-35��c��OH-��
10-5mol/L��c��Al3+����c3��OH-��=10-35��c��OH-��![]() =1
=1![]() 10-10mol/L��c��H+��
10-10mol/L��c��H+��![]() 1
1![]() 10-4mol/L��pH
10-4mol/L��pH![]() 4��pH���ٴﵽ4��ʹFe3+��Al3+������ȫ��
4��pH���ٴﵽ4��ʹFe3+��Al3+������ȫ��
��3�����백ˮ����pH��5.4�����˺�����AΪFe��OH��3��Al��OH��3����Һ�к�MnSO4��ZnSO4��CuSO4����NH4��2SO4������Һ�м���MnS���������У�����������ת���γ����ܵ�ZnS��CuS��Zn2+��Cu2+��ȥ�����˵õ�������B�ijɷ�ΪZnS��CuS��
��4�����������������MnSO4��������MnO2���������缫��ӦʽΪMn2+-2e-+2H2O=MnO2+4H+��
��5��MnO2����������KI��Ӧ�����ӷ���ʽΪ��MnO2+4H++2I-=Mn2++I2+2H2O���ó���ϵʽ��MnO2~I2~2Na2S2O3��n��MnO2��=![]() n��Na2S2O3��=
n��Na2S2O3��=![]() 0.08mol/L
0.08mol/L![]() 0.025L
0.025L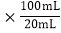 =0.005mol��m��MnO2��=0.005mol
=0.005mol��m��MnO2��=0.005mol![]() 87g/mol=0.435g������Ʒ����Ϊ
87g/mol=0.435g������Ʒ����Ϊ![]() 100%=47.3%��
100%=47.3%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
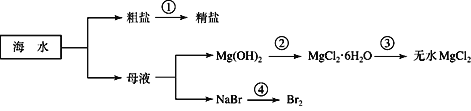
����Ŀ���������зḻ����Դ������ͼ��ʾ���ú�ˮ�ɻ���������Ʒ��
�����й�˵����ȷ����
A. �ڢٲ��г�ȥ�����е�Ca2����Mg2����SO42�������ʣ�������Լ�˳��Ϊ��Na2CO3��Һ��NaOH��Һ��BaCl2��Һ�����˺������
B. �ڢڲ��ǽ�������þ�����ᷴӦ��Ȼ�����������Һ�õ�����
C. �ڢ۲��еķ�Ӧ�����Ȼ��������н���
D. �ڢܲ�����Ԫ�ر���ԭ�����������Ȼ�̼��ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л�ѧ��Ӧ����ʵ,˵����Ӧ�����������ʲô����,����ʾ���ʵ�ѡ�����ĸ���ڸ�С��ĺ�����.
A.���ӷ��� B.���� C.��ˮ�� D.��ˮ�� E.ǿ������ F ǿ����
��1��Ũ���������������___________________
��2�������м�Ũ![]() �����������������__________________
�����������������__________________
��3��![]() (ϡ)=
(ϡ)=![]() _________________
_________________
��4��![]() _________________
_________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��X��Y��Z��W�����ڱ��е�λ����ͼ��ʾ������ZԪ�ص��������������ڲ����������1/2������˵������ȷ���ǣ� ��
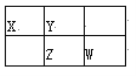
A. ZԪ��λ�����ڱ��ĵ������ڵ�VA��
B. X��WԪ�ص�����������Ӧˮ��������ԣ�Wǿ��X
C. YԪ�ص���̬�⻯������ȶ��Ա�Z�ĸ�
D. X��W�γɹ��ۻ�����XW2, X��ԭ�Ӱ뾶��YС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��25�桢101kPaʱ��1gCH4��ȫȼ������Һ̬ˮʱ�ų���������55.64 kJ�����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��___________________________________________��
(2)Һ��ʯ��������Ҫ�ɷ��DZ��飬����ȼ�յ��Ȼ�ѧ����ʽΪC3H8(g)��5O2(g)===3CO2(g)��4H2O(l)
��H����2 220.0 kJ�� mol��1����֪CO����ȼ�յ��Ȼ�ѧ����ʽΪ2CO(g)��O2(g)===2CO2(g) ��H����565.14 kJ��mol��1���Լ�����ͬ���ʵ�����C3H8��COȼ�ղ����������ı�ֵ________(����С�����һλ)��
(3)���������뵪��������Ӧ����������������Ӧ�����Ƿ�Ӧ������ȴ����ͬ��
��֪��2H2(g)��O2(g)===2H2O(g) ��H����483.6 kJ�� mol��1
3H2(g)��N2(g)![]() 2NH3(g) ��H����92.4 kJ�� mol��1
2NH3(g) ��H����92.4 kJ�� mol��1

�������1 mol N��N����Ҫ��������________kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. ������ˮ��Ӧ��Cl2+H2O ![]() Cl-+ClO��+2H+
Cl-+ClO��+2H+
B. �������Һ������������Һ��Ӧ��Ba2++![]() === BaSO4��
=== BaSO4��
C. ��������������Һ�ڿ����б�������4Fe2����O2��4H����4Fe3����2H2O
D. ̼��������Һ�����ij���ʯ��ˮ��ϣ�2![]() +Ca2++2OH�� === CaCO3��
+Ca2++2OH�� === CaCO3��![]() +2H2O
+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C�����ձ��зֱ�ʢ����ͬ���ʵ���Ũ�ȵ�ϡ���ᣬ����ͼ��ʾ��

��1��A�з�Ӧ�����ӷ���ʽ��______��
��2��B��Sn���ĵ缫��ӦʽΪ____��Sn��������Һ��pH____����������������С����������������
��3��C�б���ʴ�Ľ�����____���ܷ�Ӧ���ӷ���ʽ��____���Ƚ�A��B��C��������ʴ�������ɿ쵽����˳����____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����(N2H4)�ֳ���������һ�ֿ�ȼ��Һ�壬���������ȼ�ϡ���֪0.4 mol N2H4(l)������H2O2(l)��Ӧ�����ɵ�����ˮ�������ų�256.65 kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ_______________���£�����ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������Һ��20%��30%��KOH��Һ���£�����ȼ�ϵ�طŵ�ʱ�������ķ�Ӧʽ��_________________________________�������ķ�Ӧʽ��____________________________________��
��2����һ�ܱ������г���1 mol H2��1 mol I2��ѹǿΪP(Pa)������һ���¶���ʹ�䷢����Ӧ��H2��g)��I2��g)=2HI��g) ��H<0���Իش���������ʼʱ�ķ�Ӧ�¶ȣ���Ӧ���ʽ�___________�����������С�����䡱����ͬ���������������ݻ���Сһ�룬��Ӧ���ʽ�___________���������������ݻ����䣬�����м���1 mol N2��N2���μӷ�Ӧ������Ӧ���ʽ�__________������������������ѹǿ���䣬�����м���1 mol N2��N2���μӷ�Ӧ������Ӧ���ʽ�____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҺX�п��ܺ���K����Mg2����Al3����AlO��SiO��CO��SO��SO�е����������ӡ�ijͬѧ�Ը���Һ����������ʵ�飺

�����ж���ȷ����( )
A. �����һ���Ǵ����� B. �������ǹ������þ�Ļ����
C. K����AlO��SiOһ����������ҺX�� D. CO��SOһ������������ҺX��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com