
【题目】(1)在25℃、101kPa时,1gCH4完全燃烧生成液态水时放出的热量是55.64 kJ,则表示甲烷燃烧热的热化学方程式是___________________________________________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2 220.0 kJ· mol-1,已知CO气体燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-565.14 kJ·mol-1,试计算相同物质的量的C3H8和CO燃烧产生的热量的比值________(保留小数点后一位)。
(3)氢气既能与氮气发生反应又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ· mol-1
3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92.4 kJ· mol-1
2NH3(g) ΔH=-92.4 kJ· mol-1

计算断裂1 mol N≡N键需要消耗能量________kJ。
【答案】CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.24 kJ· mol-1 7.9 946
【解析】
(1)物质的量与热量成正比,结合焓变及状态书写热化学方程式;
(2)根据热化学方程式计算相同物质的量的丙烷和一氧化碳完全燃烧生成气态产物时产生的热量之比;
(3)反应物总键能-生成物总键能=反应热,据此计算。
(1)1g CH4完全燃烧生成液态水时放出的热量是55.64kJ,则1molCH4在氧气中燃烧生成CO2和液态水,放出热量为55.64kJ×16=890.24 kJ热量,可知热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.24 kJ· mol-1;
(2)根据热化学方程式可知,1mol的丙烷和1mol的一氧化碳完全燃烧生成气态产物时产生的热量之比为2220.0kJmol-1:![]() kJmol-1≈7.9;
kJmol-1≈7.9;
(3)N≡N键能为x,则3×436kJ/mol+x-2×1173.2kJ/mol=-92.4kJ/mol,解得x=946kJ/mol,故断裂1mol N≡N键需要能量是946kJ。


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示转化关系,且ΔH=ΔH1+ΔH2,则X、Y可能是
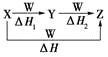
①C、CO ②S、SO2③AlCl3、Al(OH)3④Na2CO3、NaHCO3⑤Fe、FeCl2
A. ①②③④⑤B. ②④⑤
C. ①③④D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向![]() 溶液中滴加HI溶液:
溶液中滴加HI溶液:![]()
B. 用铜电极电解氯化钠溶液:![]()
C. 向![]() 溶液中加入过量氨水:
溶液中加入过量氨水:![]()
D. 向![]() 溶液中滴加稀盐酸:
溶液中滴加稀盐酸:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原料从杨树中提取,现可用如下反应制备:

下列叙述错误的是
A. X、Y和Z均能使溴水褪色,且原理相同
B. X和Z均能与Na2CO3溶液反应放出CO2
C. Z中含手性碳原子
D. Y可作加聚反应的单体,X可作缩聚反应的单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图。回答下列问题:

(1)该反应的化学方程式为 。
(2)0~t1 s内A气体的反应速率为 。
(3)反应后与反应前的压强之比为 。
(4)(t1+10)s时,A气体的体积分数为 ,此时v(A)正 v(B)逆(填“>”、“<”或“=”)。
(5)关于该反应的说法正确的是 。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其处理流程图如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-35 | 10-6 | 10-38 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______________________。
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___________;滤渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH 至少达到____________,恰好能使Fe3+、A13+沉淀完全。(当离子浓度降到1.0×10-5mol·L-1时即视为沉淀完全)
(3)滤渣B的成分是___________________。
(4)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极电极反应式为_____________________________________________________。
(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI 溶液充分反应后,配制成100mL溶液。取其中20.00mL,恰好与25.00mL 0.0800mol·L-1Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算可得该样品纯度_____%。(小数点后保留1位数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)画出磷原子的原子结构示意图:______。
(2)写出H2S分子的电子式:________。
(3)写出表示含有8个质子,10个中子的原子的化学符号:______。
(4)已知阴离子aXm—和阳离子bYn+具有相同的核外电子排布,则a、b、m、n之间的关系为a=____。
(5)用电子式表示氯化镁的形成过程:____。
(6)写出Na2O2中所含化学键的类型______。
(7)拆开1mol H—H键,1mol N—H键, 1mol![]() 键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3___热量(填“吸收”或“放出”)___kJ;
键分别需要吸收的能量为436kJ ,391kJ,946kJ:则1mol N2完全转化成NH3___热量(填“吸收”或“放出”)___kJ;
(8)利用下列反应:Fe+Cu2+=Fe2++Cu 制一个化学电池,写出电极反应式:负极:___;正极__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成生石灰;②在海水中加入生石灰,过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤;④在氯化氢热气流中加热晶体;⑤电解上述所得盐(熔融条件下)。下列说法正确的是( )
A.向洗涤液中滴加氯化钙溶液可检验沉淀是否洗涤干净
B.上述变化过程中包括了分解、化合、复分解、置换等四种反应类型
C.步骤④在氯化氢热气流中加热晶体的目的是为了防止氯化镁水解
D.步骤⑤也可以采用电解该盐水溶液的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g),下列叙述中不正确的是( )

A. Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有32.5g锌溶解时正极放出22.4 L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com