
����Ŀ��ͭ����������ʹ�õĽ���֮һ������ͭ���仯�����ڹ�ҵ��������������;�dz��㷺���ش��������⣺
��1����̬+2��ͭ����M�ܲ�����Ų�ʽ��___________����4�����л�̬ԭ��δ�ɶԵ�������ͭԭ����ͬ��Ԫ����________�֡�
��2��Cu+����SCN-�γ�CuSCN��������д��һ����SCN-��Ϊ�ȵ��������_________��SCN-��Ӧ�����������ᣨH-S-CN�����������ᣨH-N=C=S�������������۵���ߵ���_______�������ƣ���ԭ����_____________________��
��3��Cu2+����NH3�γ�ƽ�������ε�[Cu(NH3)4]2+��NH3���ӵĿռ乹��Ϊ__________��[Cu(NH3)4]2+��Cu��ȡdspx�ӻ���x��ֵ��__________��
��4����֪Cu2O �۵�Ϊ1235 �棬K2O �۵�Ϊ770����ǰ���۵�ϸߣ���ԭ����___________��
��5��Cu3N �ľ������������ṹ����ͼ��ʾ��
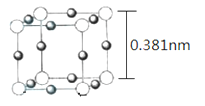
�پ������������Cu+��ľ���Ϊ________nm����������λС����
��Cu3N ������ܶ�Ϊ____________ g��cm-3����NA��ʾ����٤��������ֵ���г�����ʽ�����ؼ���������
���𰸡� 3s23p63d9 4 CO2 �� CS2 �� N2O �������� ����������Ӽ��γ���� ������ 2 ���߶������Ӿ��壬 Cu+���Ӱ뾶��K+С�������ܴ� 0.27 ![]() ��
��![]()
����������1�����������ͭ��29��Ԫ�أ����̬ԭ�ӵļ۵����Ų�ʽΪ[Ar] 3d94s1����δ�ɶԵ�����Ϊ2����̬+2��ͭ����M�ܲ㣨��3���Ӳ㣩�����Ų�ʽΪ3s23p63d9����4�����л�̬ԭ��δ�ɶԵ�������ͭԭ����ͬ��2��δ�ɶԵ��ӣ���Ԫ����Ti��Ni��Ge��Se��4�֡�
��2����SCN-��Ϊ�ȵ���������ж��֣�����3��ԭ�Ӻ�16���۵��ӣ����ݵȵ���ԭ�������ҵ�CO2��CS2��N2O �ȵ���SCN-��Ӧ�����������ᣨH-S-CN�����������ᣨH-N=C=S�������������۵���ߵ����������ᣬԭ��������������Ӽ�����γ������
��3��NH3������NΪsp3�ӻ���N��1���µ��Ӷԣ�����ռ乹��Ϊ�����Σ�[Cu(NH3)4]2+��Cu��ȡdspx�ӻ������� [Cu(NH3)4]2+�γ�ƽ�������νṹ���������ӻ������ĿΪ4�������x��ֵ��2��
��4����֪Cu2O �۵�Ϊ1235 �棬K2O �۵�Ϊ770�棬ǰ���۵�ϸߣ���ԭ���Ƕ��߶������Ӿ��壬����Cu+���Ӱ뾶��K+С����Cu2O����ľ����ܽϴ�
��5����Cu3N �ľ������������ṹʾ��ͼ��֪���þ����ı߳�Ϊ0.381nm���� Cu3N�Ļ�ѧʽ��֪���������ӵĸ�����Ϊ1:3�������а��������������![]() �����������������
�����������������![]() ����������������ӡ����������ͭ���ӡ�
����������������ӡ����������ͭ���ӡ�
����ͼ��֪���ڽ���������ͭ������һ�������ӿ����һ������ֱ�������Σ��ʾ������������Cu+��ľ���Ϊ![]() 0.27nm��
0.27nm��
��1mol Cu3N����������������ֱ�Ϊ(![]() )g��
)g��![]() �����ԣ�Cu3N ������ܶ�Ϊ
�����ԣ�Cu3N ������ܶ�Ϊ![]() g��cm-3��
g��cm-3��![]() g��cm-3��
g��cm-3��


 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����Ͱ�ˮ�ĵ��볣����Ϊ1.8��10-5����ȡŨ�Ⱦ�Ϊ0.1mol/L�Ĵ�����Һ�백ˮ��20mL���ֱ���0.1mol/L��NaOH��Һ��0.1mol/L��������к͵ζ����ζ�������pH�μ���Һ������仯��ϵ��ͼ��ʾ������˵����ȷ����
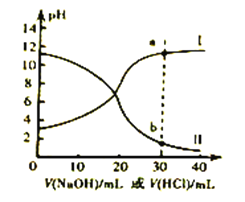
A. ����I�У��μ���Һ��10mLʱ:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-)
B. ����II�У��μ���Һ��20mLʱ: c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. ����II�У��μ���Һʱʼ�մ���: c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D. ����a��b�����Ӧ����Һ���,������Һ������pH<7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ���Ӿ��ּӴף���ʹ�˱��ζ��ɿڣ�ԭ����
A. �������������� B. ��������������
C. �������������� D. �����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ����
A. ����NA����ԭ�ӵĺ����ڱ�״���µ����ԼΪ11.2L
B. ������32g�������������������У�������2NA����ԭ��
C. 56g���� ������ˮ������Ӧ��ת�Ƶĵ�����Ϊ3NA
D. 100mL0.1mol/L������Һ���е���������Ϊ0.01NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2Sx�ڼ�����Һ�пɱ�NaClO����ΪNa2SO4����NaClO����ԭΪNaCl������Ӧ��Na2Sx��NaClO�����ʵ���֮��Ϊ1:16����xֵ��
A. 5 B. 4 C. 3 D. 2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Na2CO3��Һ���Ƶ�NaHCO3��NaOH��ԭ����ͼ��ʾ��
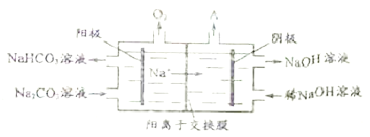
��1����������HCO3- �ĵ缫��ӦʽΪ________________________________����������������A�Ļ�ѧʽΪ______________��
��2������һ��ʱ����������Ƶ�NaHCO3��NaOH�����ʵ���֮��ԼΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ˮ�г�����һ������Cr2O72-��CrO42-�����ǻ�����༰��̬ϵͳ�����ܴ���Ҫ���б�Ҫ�Ĵ�����
������������Һ�д�������ƽ�⣺2CrO42-(��ɫ)+2H+![]() Cr2O72-(��ɫ)+H2O
Cr2O72-(��ɫ)+H2O
�ֶ�ij��ҵ��ˮ���м�Ⲣ��������������ش��������⣺
(һ)ȡ���ù�ҵ��ˮ��������и��ĺ�����
�����: ȡ25.00 mL��ˮ����������ϡ�����ữ��
�����������ĵ⻯����Һ��Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2OȻ����뼸��ָʾ���������һ�������0.1000mol��L-1 Na2S2O3��Һװ���ʽ�ζ����У����еζ��������ζ�������£���I2+2Na2S2O3
2Cr3++3I2+7H2OȻ����뼸��ָʾ���������һ�������0.1000mol��L-1 Na2S2O3��Һװ���ʽ�ζ����У����еζ��������ζ�������£���I2+2Na2S2O3![]() 2NaI+Na2S4O6��
2NaI+Na2S4O6��
�ζ����� | Na2S2O3��Һ��ʼ����/mL | Na2S2O3��Һ�յ����/mL |
��һ�� | 1.02 | 19.03 |
�ڶ��� | 2.00 | 19.99 |
������ | 0. 20 | 18.20 |
�����:��������Ӧ����Һ����pH���ڡ����˵ȴ��������ճ�������Һ������ˮ����
��1����������ϡ�����ữ��Ŀ����_____________________________��
��2�����E���жϵζ��ﵽ�յ��������___________________________��
��3�����²�������ɷ�ˮ�и������ⶨֵƫ�ߵ���_________________��
A. �ζ��յ����ʱ�����ӵζ��ܵĿ̶�
B. ʢװ����Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ
C. �ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ
D. ��ϴ��δ�ñ�Һ��ϴ��ʽ�ζ���
��4��25.00mL��ˮ���ữ����Cr2O72- �����ʵ���Ϊ___________mol.
(������ԭ��������Cr2O72-��CrO42-
�÷����Ĺ�������Ϊ��

��5����˵���ڢٲ���Ӧ�ﵽƽ��״̬����_____________��������ĸ���ţ�
a. Cr2O72- ��CrO42- ��Ũ����ͬ
b. 2v(Cr2O72-)=v(CrO42-)
c. ��Һ����ɫ����
��6���ڢڲ��У���ԭ1molCr2O72-���ӣ���Ҫ________mol��FeSO4��7H2O��
��7�������£�Cr(OH)3���ܶȻ�Ksp=10-32��Ҫʹc(Cr3+)����10-5 mol��L-1����Һ��pHӦ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. Na��H2O�ķ�Ӧ���ؼ��ķ��ȷ�Ӧ���÷�Ӧ���Է�����
B. AgCl��ͬŨ�ȵ�CaCl2��NaCl��Һ�е��ܽ����ͬ
C. FeCl3��MnO2���ɼӿ�H2O2�ֽ⣬ͬ�������¶��߶�H2O2�ֽ����ʵĸı���ͬ
D. Mg(OH)2��������Һ�д���ƽ�⣺Mg(OH)2(s)![]() Mg2��(aq)��2OH��(aq)���ù��������NH4Cl��Һ
Mg2��(aq)��2OH��(aq)���ù��������NH4Cl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. 0.1mol/LpHΪ9��NaHB��Һ��:c(HB-)>c(B2-)>c(H2B)
B. ����״���µ�2.24LCO2ͨ��150mL1mol/LNaOH��Һ�У�������Һ��c(CO32-)>c(HCO3-)
C. �����£�c(NH4+)��ͬ�Ģ�(NH4)2CO3��(NH4)2SO4��(NH4)2Fe(SO4)2��ҺŨ�ȴ�С˳��Ϊ:��>��>��
D. ����ʱ��pH=12�İ�ˮ��pH=12��NaOH��Һ��������Һϡ����ͬ��������Һ��pH:��>��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com