
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,要进行必要的处理。
两种离子在溶液中存在如下平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
现对某工业废水进行检测并做沉降处理,请回答下列问题:
(一)取样该工业废水,检测其中铬的含量。
步骤Ⅰ: 取25.00 mL废水,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1 Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3
2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1 Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3![]() 2NaI+Na2S4O6)
2NaI+Na2S4O6)
滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
笫一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | 18.20 |
步骤Ⅳ:将上述反应后溶液进行pH调节、过滤等处理,回收沉淀,滤液倒入下水道。
(1)步骤Ⅰ加入稀硫酸酸化的目的是_____________________________;
(2)步驟Ⅱ判断滴定达到终点的现象是___________________________;
(3)以下操作会造成废水中铬含量测定值偏高的是_________________;
A. 滴定终点读数时,俯视滴定管的刻度
B. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 清洗后未用标准液润洗碱式滴定管
(4)25.00mL废水经酸化后,含有Cr2O72- 的物质的量为___________mol.
(二)还原沉淀法除Cr2O72-和CrO42-
该方法的工艺流程为:

(5)能说明第①步反应达到平衡状态的是_____________;(填字母代号)
a. Cr2O72- 和CrO42- 的浓度相同
b. 2v(Cr2O72-)=v(CrO42-)
c. 溶液的颜色不变
(6)第②步中,还原1molCr2O72-离子,需要________mol的FeSO4·7H2O。
(7)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5 mol·L-1,溶液的pH应调至___________。
【答案】 使CrO42- 充分转化成Cr2O72-(便于在步骤Ⅱ中被I-充分还原) 溶液由蓝色变为无色,且在半分钟内不变色 C D ![]() c 6 5
c 6 5
【解析】(1)根据平衡移动原理,步骤Ⅰ加入稀硫酸酯化的目的使使CrO42- 充分转化成Cr2O72-,便于在步骤Ⅱ中被I-充分还原;(2)滴定达到终点时碘单质刚好被消耗,所以溶液的颜色由蓝色变为无色,且在半分钟内不变色;(3)根据Cr2O72﹣+6I﹣+14H +═2Cr3++3I2+7H2O和I2+2Na2S2O3═2NaI+Na2S4O6,则c(待测)偏高,Cr2O72﹣含量就偏高;A.滴定终点读数时,俯视滴定管的刻度,造成V(标准)偏小,根据c(待测)=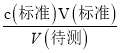 分析,测定c(待测)偏低,选项A错误;B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗,对V(标准)无影响,根据c(待测)=
分析,测定c(待测)偏低,选项A错误;B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗,对V(标准)无影响,根据c(待测)=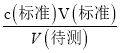 分析,测定c(待测)无影响,选项B错误;C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(标准)偏大,根据c(待测)=
分析,测定c(待测)无影响,选项B错误;C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成V(标准)偏大,根据c(待测)=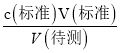 分析,测定c(待测)偏高,选项C正确; D.未用标准液润洗碱式滴定管,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=
分析,测定c(待测)偏高,选项C正确; D.未用标准液润洗碱式滴定管,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=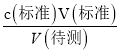 分析,测定c(待测)偏高,选项D正确。答案选CD;(4)三次滴定消耗Na2S2O3溶液的体积分别为18.01mL、17.99mL、18.00mL,平均消耗体积为18.00mL,根据反应Cr2O72-+6I-+14H+
分析,测定c(待测)偏高,选项D正确。答案选CD;(4)三次滴定消耗Na2S2O3溶液的体积分别为18.01mL、17.99mL、18.00mL,平均消耗体积为18.00mL,根据反应Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2O,I2+2Na2S2O3
2Cr3++3I2+7H2O,I2+2Na2S2O3![]() 2NaI+Na2S4O6,可得关系Cr2O72-~~3I2~~~6Na2S2O3,25.00mL废水经酸化后,含有Cr2O72- 的物质的量为
2NaI+Na2S4O6,可得关系Cr2O72-~~3I2~~~6Na2S2O3,25.00mL废水经酸化后,含有Cr2O72- 的物质的量为![]() ×18mL×10-3L/mL×0.1000mol/L=
×18mL×10-3L/mL×0.1000mol/L= ![]() ;(5)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,a.Cr2O72- 和CrO42-的浓度相同取决于起始浓度和转化,不能判断平衡,选项a错误; b.2v(Cr2O72-)=v(CrO42-),不能判断正逆反应速率关系,不能判断平衡,选项b错误; c.溶液的颜色不变,为特征定,能判断平衡,选项c正确;答案选c;(3)第②步反应中,根据反应Cr2O72-+6Fe2++14H+=2Cr3+ +6Fe3++7H2O可知,还原1molCr2O72-离子,需要6mol的FeSO4·7H2O;(7)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5 mol·L-1,c(OH-)=
;(5)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,a.Cr2O72- 和CrO42-的浓度相同取决于起始浓度和转化,不能判断平衡,选项a错误; b.2v(Cr2O72-)=v(CrO42-),不能判断正逆反应速率关系,不能判断平衡,选项b错误; c.溶液的颜色不变,为特征定,能判断平衡,选项c正确;答案选c;(3)第②步反应中,根据反应Cr2O72-+6Fe2++14H+=2Cr3+ +6Fe3++7H2O可知,还原1molCr2O72-离子,需要6mol的FeSO4·7H2O;(7)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5 mol·L-1,c(OH-)=![]() =10-9mol/L,溶液的pH应调至5。
=10-9mol/L,溶液的pH应调至5。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质,下列说法正确的是 ( )


A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部反应
B. Ⅱ图中:生成蓝色的烟
C. Ⅲ图中:用日光照射量筒,量筒中会产生大量白雾,液面会迅速上升
D. Ⅳ图中:a中有色布条褪色,b中不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是主要大气污染物之一,工业上可用如图装置吸收转化SO2(A、B 为惰性电极)。下列说法错误的是( )

A. a为电源的正极
B. B 极上发生氧化反应
C. 离子交换膜为阳离子交换膜
D. A极区溶液的pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一,金属铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)基态+2价铜离子M能层电子排布式是___________;第4周期中基态原子未成对电子数与铜原子相同的元素有________种。
(2)Cu+能与SCN-形成CuSCN沉淀。请写出一种与SCN-互为等电子体的微粒_________。SCN-对应的酸有硫氰酸(H-S-CN)和异硫氰酸(H-N=C=S),这两种酸熔点更高的是_______(填名称),原因是_____________________。
(3)Cu2+能与NH3形成平面正方形的[Cu(NH3)4]2+。NH3分子的空间构型为__________;[Cu(NH3)4]2+中Cu采取dspx杂化,x的值是__________。
(4)已知Cu2O 熔点为1235 ℃,K2O 熔点为770℃,前者熔点较高,其原因是___________。
(5)Cu3N 的晶胞(立方)结构如下图所示:
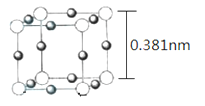
①距离最近的两个Cu+间的距离为________nm。(保留两位小数)
②Cu3N 晶体的密度为____________ g·cm-3。(NA表示阿伏伽德罗常数的值,列出计算式,不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型中温全瓷铁一空气二次电池,其结构如图所示。下列有关该电池的说法正确的是

A. 放电时O2-从a移向b B. 放电时负极的电极反应为O2+4e-=2O2-
C. 充电时1molFe 氧化为FeOx,转移2xmole- D. 充电时a 与电源的负极相连。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有不同溶液的烧杯中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
①I图对应溶液中的溶质为NaHCO3
②II图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1:1
③III图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1:1
④IV图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N 是一种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子的核外电子排布式是_____________;最高能级的电子云轮廓图形状为_____________;N原子的第一电离能比O原子的大,其原因是_________________________。
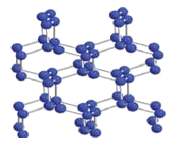
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是______________________。
(3)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,经X射线衍射测得晶体结构,其局部结构如图所示(其中N5-的立体结构是平面五元环)。下列说法正确的是________。
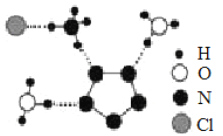
A.所有N 原子的价电子层均有孤对电子 B.两种阳离子均含有配位键
C.两种阳离子不是等电子体 D.阴阳离子之间只存在离子键
(4)NH3 与F2 反应生成NF3 和NH4F,这四种物质中,沸点由高到低的顺序是______;NF3中氮元素显_______价;属极性分子的有_________________。
(5)立方氮化硼称为超硬材料。晶胞结构如图所示:
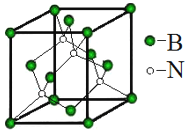
硼原子的配位数是__________。若晶胞参数为anm,则晶体的密度为____g·cm3 (用NA 表示阿伏伽德罗常数的值,列出代数式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)制备NaBiO3,其流程如下:
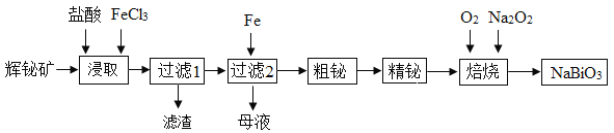
已知:水解能力:Bi3+>Fe3+。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有______(任写一条);过滤1的滤渣的主要成分有______(填化学式)。
(2)浸取时加入过量浓盐酸的目的是______;“母液”中通入气体X后可循环利用,气体X为______(填名称)。
(3)写出焙烧时生成铋酸钠的化学方程式______;当消耗标准状况下4.48 L O2时,转移电子的数目是______。
(4)25℃时,向浓度均为0.04 mol·L-1的Cu2+、Pb2+、Bi3+的混合溶液中滴加(NH4)2S溶液(设溶液体积增加1倍),当c(Pb2+)=10-5 mol·L-1时恰好完全沉淀,所得溶液中c(Cu2+)∶c(Bi3+)=______。[已知:Ksp(CuS)=6.0×10-36、Ksp(PbS)=3.0×10-28、Ksp(Bi2S3)=1.6×10-20]
(5)用双硫腙(H2Dz,二元弱酸)~CC14络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。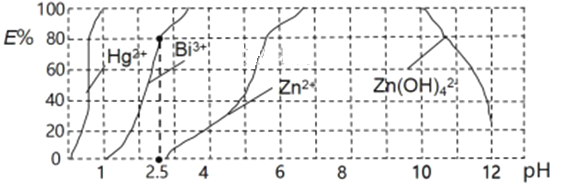
①当调节pH=2.5时,铋(Bi)的存在形式有______。
②向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/L CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/[c(CH3COOH).c(OH-)]增大
C. 向盐酸中加入氨水至中性,溶液中[c(NH4+)/c(Cl-)]>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com