
【题目】某新型中温全瓷铁一空气二次电池,其结构如图所示。下列有关该电池的说法正确的是

A. 放电时O2-从a移向b B. 放电时负极的电极反应为O2+4e-=2O2-
C. 充电时1molFe 氧化为FeOx,转移2xmole- D. 充电时a 与电源的负极相连。
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】雷尼镍(Raney-Ni)是一种多孔结构的镍铝合金,对氢气具有强吸附性,是烯烃、炔烃氢化反应的高效催化剂。一种以铜镍渣(主要含Cu、Fe、Co和Ni)生产雷尼镍的流程如下:
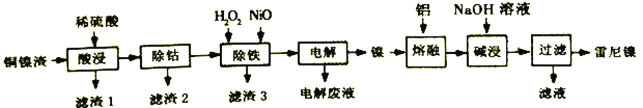
下表列出了有关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“酸浸”时,如通入空气并不断搅拌,可将“滤渣1”氧化溶解,离子方程式为___________。
(2)“除铁”时,先加入适量H2O2氧化Fe2+,理论上消耗的n(H2O2):n(Fe2+)=____;再加入NiO以调节溶液的pH。应控制pH的范围为__________________。
(3)“电解”(以惰性材料作电极)是为了获得单质镍。电解产物中可循环利用的物质是_______。
(4)“碱浸”是为了形成多孔结构的雷尼镍,反应的离子方程式为_________________。使用新制雷尼镍进行氢化反应时,不加氢气也可实现氢化的目的,原因是____________________。
(5)“滤液”主要成分与过量CO2反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
A. 5 B. 4 C. 3 D. 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中富含碘元素.从海带中提取碘有如下步骤:( ) ①将海带焙烧成灰(生成KI) ②加水使KI溶解,充分搅拌后过滤 ③在滤液通入足量Cl2
④加CCl4振荡 ⑤静置后,用分液漏斗分液 合理的操作顺序是.
A.①②③④⑤
B.②⑤①③④
C.①③⑤②④
D.②①③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,要进行必要的处理。
两种离子在溶液中存在如下平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
现对某工业废水进行检测并做沉降处理,请回答下列问题:
(一)取样该工业废水,检测其中铬的含量。
步骤Ⅰ: 取25.00 mL废水,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1 Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3
2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1 Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3![]() 2NaI+Na2S4O6)
2NaI+Na2S4O6)
滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
笫一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | 18.20 |
步骤Ⅳ:将上述反应后溶液进行pH调节、过滤等处理,回收沉淀,滤液倒入下水道。
(1)步骤Ⅰ加入稀硫酸酸化的目的是_____________________________;
(2)步驟Ⅱ判断滴定达到终点的现象是___________________________;
(3)以下操作会造成废水中铬含量测定值偏高的是_________________;
A. 滴定终点读数时,俯视滴定管的刻度
B. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 清洗后未用标准液润洗碱式滴定管
(4)25.00mL废水经酸化后,含有Cr2O72- 的物质的量为___________mol.
(二)还原沉淀法除Cr2O72-和CrO42-
该方法的工艺流程为:

(5)能说明第①步反应达到平衡状态的是_____________;(填字母代号)
a. Cr2O72- 和CrO42- 的浓度相同
b. 2v(Cr2O72-)=v(CrO42-)
c. 溶液的颜色不变
(6)第②步中,还原1molCr2O72-离子,需要________mol的FeSO4·7H2O。
(7)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5 mol·L-1,溶液的pH应调至___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的有机化工原料,可用于制取氢气、甲酸甲酯(HCOOCH3)。(1) 在一定条件下用氧气催化氧化甲醇制氢气,原料气中n(O2)/n(CH3OH)对反应的选择性影响如图所示(选择性越大表示生成的该物质越多)。当n(O2)/n(CH3OH)=0.25 时,主要反应的化学方程式为____________,制备H2 时最好控制n(O2)/n(CH3OH)=___________。

(2)甲醇催化脱氢制甲酸甲酯的反应为:2CH3OH(g)![]() HCOOCH3(g)+2H2(g) △H =a kJ·mol-1
HCOOCH3(g)+2H2(g) △H =a kJ·mol-1
①已知 :CO(g)+ l/2O2(g)=CO2(g) △H1 =-283kJ·mol-1
2CH3OH(g)+O2(g)=2CO2(g)+4 H2(g) △H2 =-386kJ·mol-1
2CO(g)+2 H2(g)=HCOOCH3(g ) △H3 =-134kJ·mol-1
a=_________________。
②在310℃下,将2mol 甲醇置于VL恒容密闭容器中,反应20 分钟后到达平衡,平衡时甲醇和氢气的分压相等。从开始到平衡时甲醇的平均反应速率为____ mol·L-1·min-1,若平衡时气体总压为P总=5×104Pa,Kp=_______。(已知: Kp是用平衡气体分压代替平衡浓度求得的平衡常数。气体分压=气体总压×气体的物质的量分数)。若在310℃下,将2mol 甲醇置于VL恒压密闭容器中,反应到达平衡时甲醇的分压______氢气的分压(填“>”,“=”或“<”)。
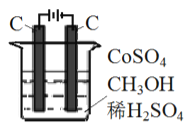
(3) 电解法可消除甲醇对水质造成的污染,原理是: 通电将Co2+ 氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如图所示装置模拟上述过程,请写出:
①阴极的电极反应式_______________________________________。
②除去甲醇的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是
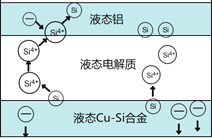
A. 在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
B. 电子由液态Cu-Si合金流出,从液态铝流入
C. 三层液熔盐的作用是增大电解反应面积,提高硅沉积效率
D. 电流强度不同,会影响硅提纯速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com