
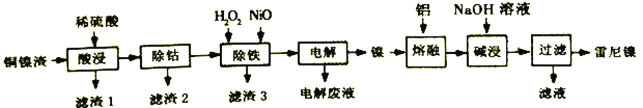
【题目】雷尼镍(Raney-Ni)是一种多孔结构的镍铝合金,对氢气具有强吸附性,是烯烃、炔烃氢化反应的高效催化剂。一种以铜镍渣(主要含Cu、Fe、Co和Ni)生产雷尼镍的流程如下:
下表列出了有关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“酸浸”时,如通入空气并不断搅拌,可将“滤渣1”氧化溶解,离子方程式为___________。
(2)“除铁”时,先加入适量H2O2氧化Fe2+,理论上消耗的n(H2O2):n(Fe2+)=____;再加入NiO以调节溶液的pH。应控制pH的范围为__________________。
(3)“电解”(以惰性材料作电极)是为了获得单质镍。电解产物中可循环利用的物质是_______。
(4)“碱浸”是为了形成多孔结构的雷尼镍,反应的离子方程式为_________________。使用新制雷尼镍进行氢化反应时,不加氢气也可实现氢化的目的,原因是____________________。
(5)“滤液”主要成分与过量CO2反应的离子方程式为__________________________。
【答案】 2Cu+4H++O2═2Cu2++H2O 1:2 3.3≤pH<7.7或[3.3, 7.7) 硫酸或H2SO4 2Al+2OH-+2H2O═2AlO2-+3H2↑ 新制雷尼镍吸附了大量氢气 AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-
【解析】试题分析:(1)根据题意,“酸浸”时,“滤渣1”是铜,通入空气并不断搅拌,铜、氧气、硫酸反应生成硫酸铜和水;(2)1mol Fe2+失1mol电子,1mol H2O2得2mol电子,根据电子守恒计算n(H2O2):n(Fe2+);加入NiO以调节溶液的pH,目的让Fe3+完全转化为沉淀,而Ni2+不能沉淀;(3)根据电解原理,以惰性材料作电极电解硫酸镍生成镍、氧气、硫酸;(4)“碱浸”时,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;新制雷尼镍吸附了大量氢气;(5)“滤液”主要成分是偏铝酸钠,偏铝酸钠与过量CO2反应生成氢氧化铝沉淀和碳酸氢钠;
解析:(1)根据题意,“酸浸”时,“滤渣1”是铜,通入空气并不断搅拌,铜、氧气、硫酸反应生成硫酸铜和水,反应离子方程式是2Cu+4H++O2═2Cu2++H2O;(2)1mol Fe2+失1mol电子,1mol H2O2得2mol电子,根据电子守恒n(H2O2):n(Fe2+)=1:2;加入NiO以调节溶液的pH,目的是让Fe3+完全转化为沉淀,而Ni2+不能沉淀,所以应控制pH的范围为3.3≤pH<7.7;(3)根据电解原理,以惰性材料作电极电解硫酸镍生成镍、氧气、硫酸,根据流程图,可以循环利用的物质是硫酸;(4)“碱浸”时,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑;新制雷尼镍吸附了大量氢气,所以不加氢气也可实现氢化;(5)“滤液”主要成分是偏铝酸钠,偏铝酸钠与过量CO2反应生成氢氧化铝沉淀和碳酸氢钠,反应离子方程式是AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、P、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如下图所示。下列说法正确的是

A. q与s均为酸性氧化物 B. 原子半径:W<Y<X
C. Z的氢化物比Y的氢化物稳定 D. Z的含氧酸是一种强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)有以下10种物质:①液态氯化氢、②CCl4、③液氯、④硫酸铵晶体、⑤铁、⑥稀硫酸、⑦澄清石灰水、⑧二氧化硫,⑨熔融的硫酸钠、⑩Na2O固体。其中属于电解质的是_______(填序号,下同),属于非电解质的是_________,在现状态下能导电的是__________,写出④在水溶液中电离的方程式__________。
(Ⅱ)A、B、C是三种元素的原子,质子数都小于18。A原子与B原子的最外层电子数都是6,A原子与C原子的核外电子层数都为3, C原子的质子数比A少4。回答下列问题:
(1)C的离子结构示意图为_________;
(2)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42-,1mol AB42-的质量为104g,则元素B的该核素中的中子数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列给定条件的溶液中,一定能大量共存的离子组是
A. 无色溶液:Ca2+、H+、Cl-、HSO3-
B. 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C. FeCl2溶液:K+、Na+、SO42-、NH3·H2O
D. 常温下 mol·L-1 的溶液:Na+、K+、SiO32-、NO3-
mol·L-1 的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质,下列说法正确的是 ( )


A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部反应
B. Ⅱ图中:生成蓝色的烟
C. Ⅲ图中:用日光照射量筒,量筒中会产生大量白雾,液面会迅速上升
D. Ⅳ图中:a中有色布条褪色,b中不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬与铁具有相似的化学性质。醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
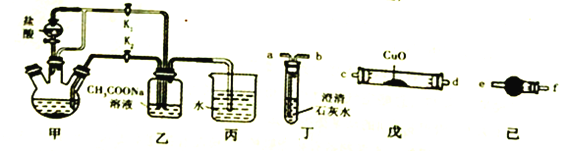
I.组装实验仪器后,首先进行必要的操作A。
II.往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液,再往其它仪器中加入相应的药品。
III.关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
IV.待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液自动转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗旋塞。
V.将装置乙中混合物快速过滤、洗涤和干燥,称量。
回答下列问题:
(1)步骤I中“操作A”为_____________;装置丙中导管口水封的目的主要是_________________________________。
(2)三颈烧瓶中的锌除与盐酸反应外,另发生的一个反应的化学方程式为_______________。
(3)步骤IV中溶液自动转移至装置乙中的实验操作为_______________;生成红棕色晶体的离子反应方程式____________________________。
(4)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________(填序号)。
①乙醚②蒸馏水(煮沸冷却) ③无水乙醇 ④盐酸
(5)一定条件下[Cr(CH3COO)2]2·2H2O受热反应得到的气态产物含CO、CO2。请从丁、戊、己装置中选取必要装置检验这两种气体(不考虑尾气处理):
气态产物→_______________________→a(填接口字母序号)。
(6已知实验所用到的试剂中,CrCl3溶液中含溶质19.02g,0.1mol/L醋酸钠溶液为1.6L,其它反应物足量。实验后得到纯净干燥的[Cr(CH3COO)2]2·2H2O晶体11.28g,则该实验所得产品的产率为________(结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年采用中国自主知识产权的全球首套煤基乙醇工业化项目投产成功。某地用煤制乙醇的过程表示如下。

(1)Cu(NO3)2是制备“催化剂X”的重要试剂。

①气体A是_________。
②实验室中用Cu(NO3)2固体配制溶液,常加入少量稀HNO3。运用化学平衡原理简述HNO3的作用: ________。
③NaClO溶液吸收气体A的离子方程式是_________。
(2)过程a包括以下3个主要反应:
I.CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) △H1
C2H5OH(g)+CH3OH(g) △H1
II.CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5(g)+CH3OH(g) △H2
CH3COOC2H5(g)+CH3OH(g) △H2
III.CH3COOCH3(g)+H2(g)![]() CH3CHO(g)+CH3OH(g) △H3
CH3CHO(g)+CH3OH(g) △H3
相同时间内,测得CH3COOCH3转化率、乙醇和乙酸乙酯的选择性(如乙醇的选择性= ![]() )如下图所示。
)如下图所示。

①已知:△H1<0。随温度降低,反应I化学平衡常数的变化趋势是________。
②下列说法不合理的是_______。
A.温度可影响反应的选择性
B.225℃~235℃,反应I处于平衡状态
C.增大H2的浓度,可以提高CH3COOCH3的转化率
③为防止“反应III”发生,反应温度应控制的范围是____________。
④在185℃,上述反应中CH3COOCH3起始物质的量为5mol,生成乙醇的物质的量是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型中温全瓷铁一空气二次电池,其结构如图所示。下列有关该电池的说法正确的是

A. 放电时O2-从a移向b B. 放电时负极的电极反应为O2+4e-=2O2-
C. 充电时1molFe 氧化为FeOx,转移2xmole- D. 充电时a 与电源的负极相连。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com