
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 正反应速率加快,逆反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】(一)已知2A2(g)+B2(g)![]() 2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
(1)比较a___b(填“>、=、<”)
(2)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
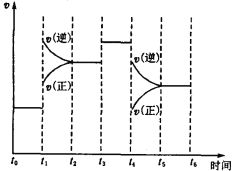
(3)下图表示此反应的反应速率v和时间t的关系图。根据下图判断,在t1和t4时刻改变的外界条件分别是_______________和 _____________ 。
(二)在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
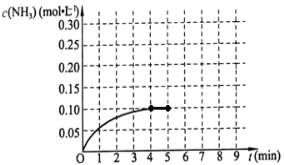
(1)根据上图,该反应达到平衡时H2的转化率等于__________。
(2)第5分钟末,保持其它条件不变,若改变反应温度,达新平衡后NH3的物质的量浓度不可能为_________。(填序号)。
a 0.20mol·L-1 b 0.12 mol·L-1 c 0.10 mol·L-1 d 0.08 mol·L-1
(3)若在第5分钟末将容器的体积缩小一半后,在第8分钟达到新的平衡(此时NH3的浓度约为0.25 mol·L-1 ),请在上图中画出第5分钟到9分钟NH3浓度的变化曲线。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)请写出元素d的基态原子电子排布式______________________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是_________________。(填“极性键”、“非极性键”)其中b原子的杂化方式是________。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为Mr,则一个晶胞中a原子的数目为________,该晶体的密度为 _______________________________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘,有人设计如下步骤:①将海带灼烧成灰,在灰中加水搅拌;②加四氯化碳充分振荡静置;③通入氯气;④过滤;⑤用分液法分离液体混合物。合理操作的先后顺序是
A. ①②③④⑤ B. ①④②③⑤
C. ①②④③⑤ D. ①④③②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.氢氧化钠的摩尔质量是40g
B.1molNaOH的质量是40g/mol
C.1gH2和1gN2所含分子数相等
D.等物质的量的N2、CH4中,所含分子数一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分中学化学常见元素原子结构及性质如表所示
元素 | 结构及性质 |
A | A在第三周期中简单离子半径最小 |
B | B原子最外层电子数是内层电子数的 |
C | 使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5 |
D | D与B同主族,且通常状况下D没有正化合价 |
E | E在周期表中位于IA族,有人认为将其排在VIIA族也有一定道理 |
F | F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应 |
(1)C元素在周期表中的位置_____________;E形成的一种简单离子能支持“将E排在VIIA族”这一观点,该离子的结构示意图为_______________________。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为________________________________。
E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式__________________________(用相应化学式表示)
(3)请画出化合物F2B2的电子式__________,该化合物中含有的化学键类型是_______。
(4)将A、C的单质用导线连接后插入F的最高价氧化物的水化物溶液中可形成原电池,该原电池中阴离子移向_________(填“A”或“C”),写出该原电池总反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗称“一滴香”的物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )

A.该有机物的分子式为C8H8O3
B.1mo1该有机物最多能与2molH2发生加成反应
C.该有机物能发生取代、加成和氧化反应
D.该有机物能与碳酸氢钠反应生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.氢氧化铝胶体可用来对自来水净化和杀菌消毒
B.“血液透析”利用了胶体丁达尔效应
C.BaSO4常用来作胃镜中的“钡餐”
D.为了消除碘缺乏病,在食用盐中加入一定量的碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有反应4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),已知2 mol O2被还原时,放出a kJ的热量,且知断开1 mol O=O键需要吸收b kJ的热量,断开1 mol Cl—Cl键需要吸收c kJ的热量。则断开1 mol H—O键比断开1 mol H—Cl键所需能量高
A. (b-a-2c)/4kJB. (a+2b-4c)/8kJC. (a+b-2c)/4kJD. (2b-a-4c)/8kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com