
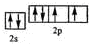
 ,该元素的名称是氧;
,该元素的名称是氧;分析 X元素原子的4p轨道上有3个未成对电子,X元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为O元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子,符合题意,以此来解答.
解答 解:X的原子4p轨道上有3个未成对电子,X元素原子的核外电子排布式为 1s22s22p63s23p63d104s24p3,处于第四周期第ⅤA族,故X为As元素;Y元素原子的最外层2p轨道上有2个未成对电子,Y的2p轨道上有2个电子或4个电子,所以Y为碳元素或氧元素,X跟Y可形成化合物X2Y3,故Y为氧元素;X、Y和Z三种元素的原子序数之和等于42,则Z的质子数为42-8-33=1,则Z为氢元素,氢原子可以形成负一价离子.
(1)由上述分析可知,X元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3,为As元素,故答案为:1s22s22p63s23p63d104s24p3;As;
(2)Y为O元素,原子基态时的电子排布式为1s22s22p4,其价电子的轨道表示式为 ,名称为氧,故答案为:
,名称为氧,故答案为: ;氧;
;氧;
(3)X为As元素,AsH3与NH3、PH3中,键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定,所以稳定性NH3>PH3>AsH3,
故答案为:稳定性为NH3>PH3>AsH3,因键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的性质推断元素为解答的关键,侧重分析与应用能力的考查,注意电子排布及周期律的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 水中的钢闸门连接电源的负极 | B. | 金属护拦表面涂漆 | ||
| C. | 汽水底盘喷涂高分子膜 | D. | 地下钢管连接锌板 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4,B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4,B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 瓜皮果壳--可回收垃圾 | B. | 塑料--危险废物 | ||
| C. | 厨余垃圾--有机垃圾 | D. | 易拉罐--不可回收垃圾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 I.请认真观察图,然后回答问题.
I.请认真观察图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| c(H2)/mol•L-1 | c(Cl2)/mol•L-1 | v/(mol•L-1•s-1) |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A. | m=1,n=1 | B. | m=$\frac{1}{2}$,n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$,n=1 | D. | m=1,n=$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com