

分析 (1)Na2CO3溶液和CH3COOC2H5分层,分液可分离;
(2)CCl4提取碘水中的碘,为萃取法;
(3)用氢氧化钠溶液吸收CO2,为洗气;
(4)用自来水制取纯净水,水的沸点较低,利用蒸馏法制备.
解答 解:(1)分离Na2CO3溶液和CH3COOC2H5(难溶于水的液体),二者分层,选③,操作名称为分液,故答案为:③;分液;
(2)用CCl4提取碘水中的碘,碘不易溶于水,易溶于有机溶剂,选③,操作名称为萃取分液,故答案为:③;萃取分液;
(3)用氢氧化钠溶液吸收CO2,选⑤,操作名称为洗气,故答案为:⑤;洗气;
(4)用自来水制取纯净水,水的沸点较低,选④,操作名称为蒸馏,故答案为:④;蒸馏.
点评 本题考查混合物分离提纯,为高频考点,把握实验装置的作用、混合物分离方法、物质的性质为解答的关键,侧重分析与实验能力的考查,注意分离方法的选择,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
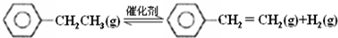
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
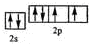 ,该元素的名称是氧;
,该元素的名称是氧;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

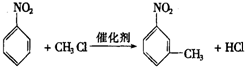 .
.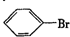 ,②
,②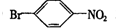 .
.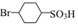 反应的化学方程式
反应的化学方程式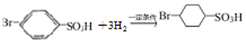 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;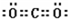 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
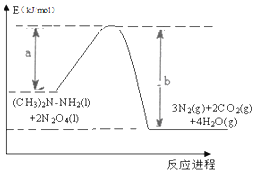 2016年10月17日上午,长征二号F型运载火箭在酒泉卫星发射中心腾空而起,成功将宇航员和“神舟十一号”飞船送入太空.火箭使用偏二甲肼【(CH3)2N-NH2】和四氧化二氮【N2 O4】作为燃料.化学反应热量变化图象如图所示:此反应的热化学方程式为:(CH3)2N-NH2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=(a-b)KJ/mol.
2016年10月17日上午,长征二号F型运载火箭在酒泉卫星发射中心腾空而起,成功将宇航员和“神舟十一号”飞船送入太空.火箭使用偏二甲肼【(CH3)2N-NH2】和四氧化二氮【N2 O4】作为燃料.化学反应热量变化图象如图所示:此反应的热化学方程式为:(CH3)2N-NH2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=(a-b)KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.
铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com