
【题目】某双原子分子构成的气体,其摩尔质量为M g/mol,该气体质量为m g,阿伏加德罗常数为NA,则:
(1)该气体的物质的量为_______________________。
(2)该气体在标准状况下的体积为______________L。
(3)该气体在标准状况下的密度为____________g/L。
(4)该气体所含原子总数为___________________个。
(5)该气体的一个分子的质量为_________________。
科目:高中化学 来源: 题型:
【题目】Al2O3常用于制造耐火坩埚,但氧化铝坩埚不能用于加热熔融下列化合物中的( )
A.NaCl B.NaNO3 C.NaOH D.Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制一种仅含四种离子(不包括水电离出的离子)的混合溶液,且在混合液中四种离子的物质的量浓度均为0.5 mol·L1,下面四个选项中能达到此目的的是
A.Fe2+、Na+、![]() 、Cl B.Mg2+、
、Cl B.Mg2+、![]() 、
、![]() 、
、![]()
C.H+、K+、Cl、CH3COO D.K+、Mg2+、![]() 、OH
、OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:
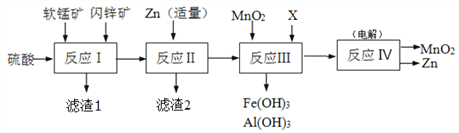
已知:反应Ⅰ中所有金属元素均以离子形式存在。
回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应的离子方程式________________________________。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,滤渣2的主要成分是______(填名称)。
(3)反应Ⅲ中MnO2的作用是______,另外一种物质X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阳极电极反应式_______________。本工艺可以循环利用的物质有MnO2、Zn和_____。
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”),理由是________________________________________。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合价是学习氧化还原反应的基础。下列化合物中,加点元素的化合价错误的是:
A. CaCO3 (+4) B. H2C2O4 (+3)
C. Na2O2 (-2) D. NH4NO3 (-3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL1mol/LNaCl溶液和50mL0.5mol/LMgCl2溶液中氯离子浓度前者与后者的关系为( )
A. 大于 B. 小于 C. 等于 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金银花中能提取出有很高药用价值的绿原酸(如图所示),下列说法不正确的是( )
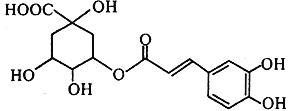
A. 绿原酸分子中有3个手性碳原子
B. 绿原酸能发生取代、加成、消去和氧化反应
C. 1mol绿原酸与NaOH溶液反应,最多消耗4mol NaOH
D. 绿原酸水解的一种产物能与FeCl3发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.10g镁铝合金加入120mL4.0mol·L-1的盐酸中,待合金完全溶解后,得到溶液X。下列说法一定正确的是
A. 合金完全溶解后产生的H2的物质的量为0.24mol
B. 合金中的镁与铝的物质的量之比小于1
C. 若向溶液X中加入270mL2.0mol·L-1NaOH溶液,充分反应,所得沉淀为Mg(OH)2
D. 若向溶液X中加入足量的氨水,充分反应,所得沉淀经过过滤、洗涤后充分灼烧,则残留固体质量大于8.50g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为_______mol·L-1 。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体
积的多少而变化的是 ______ 。
A、溶液中HCl的物质的量 B、溶液的浓度
C、溶液中Cl-的数目 D、溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 ml 物质的量浓度为0.400 mol·L-1稀盐酸。
①该学生需要量取________ ml 上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_________________;
A、用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用量筒准确量取所需浓盐酸倒入烧杯中,然后加入少量水(约30mL),并用玻璃棒慢慢搅拌,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在后面横线上填“偏高”、“偏低”、“无影响”)。
I、用量筒量取浓盐酸时俯视观察_____________
II、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水______
Ⅲ、定容时仰视视刻度线________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com