
下列有关反应限度的说法错误的是
| A.某条件下可逆反应达到限度之前,逆反应速率逐渐增大可能与生成物浓度逐渐增大有关 |
| B.炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度 |
| C.化学反应的限度决定了反应物在该条件下的最大转化率 |
| D.可逆反应的限度不随反应条件的改变而改变 |
D
解析试题分析:A.某条件下可逆反应达到限度之前,反应从正反应方向开始,逆反应速率逐渐增大,就是由于反应物不断反应变为生成物,使生成物浓度逐渐增大。物质的浓度越大,反应速率也就越快。正确。B.在炼铁高炉中发生的CO还原氧化铁的反应是可逆反应。当反应达到该条件下的反应限度时,无论高炉高度改变与否,尾气中CO含量不随而改变。正确。C.当化学反应达到该条件下的化学反应的限度时,各种反应物也就得到了在该条件下的最大转化率,因此化学反应的限度决定了反应物在该条件下的最大转化率。正确。D.可逆反应的限度是在一定条件下的限度。若外界条件发生改变,则平衡被破坏,就会达到新的条件下的新的限度,因此会随反应条件的改变而改变。错误。
考点:考查反应限度的知识。


科目:高中化学 来源: 题型:单选题
T℃时,A气体与B气体反 应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。现向一体积可变的密闭容器中通入等物质的量的A气体和B气体,在恒温条件下发生反应达到平衡状态Ⅰ后,再升高到某温度,继续反应一段时间后达到平衡状态Ⅱ。下列叙述中正确的是( )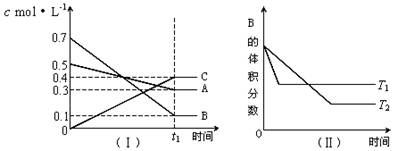
A.该反应在高温时才能自发进行
B.反应从开始到平衡状态Ⅰ的过程中,反应向正向进行,A的体积分数一直在减少
C.平衡状态Ⅰ到平衡状态Ⅱ的过程中,平衡向逆向移动,A的体积分数一直没有变化
D.反应从开始到平衡状态Ⅱ的过程中,平衡常数K和A的转化率都是先增大后减少
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(9分)在2 L密闭容器内,800℃时反应2SO2(g)+O2(g) 2SO3(g)体系中,n(SO2)随时间的变化如下表:
2SO3(g)体系中,n(SO2)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0. 010 | 0.008 | 0.007 | 0.007 | 0.007 |
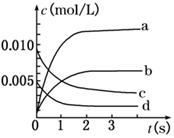
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为得出的结论不正确的是 ( )
| A.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 |
| B.将相同大小、形状的镁条和铝条分别与相同浓度的盐酸反应时,两者速率一样大 |
| C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管中再加入几滴氯化铁溶液,产生氧气的快慢不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知反应4NH3+5O2 4NO+6H2O,若在反应开始后5s~10s之间的反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列判断正确的关系是( )。
4NO+6H2O,若在反应开始后5s~10s之间的反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列判断正确的关系是( )。
A. v(NH3)=v(O2) v(NH3)=v(O2) | B.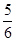 v(O2)=v(H2O) v(O2)=v(H2O) |
C.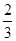 v(NH3)=v(H2O) v(NH3)=v(H2O) | D. v(O2)=v(NO) v(O2)=v(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是可逆反应X2 + 3Y2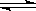 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )。
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )。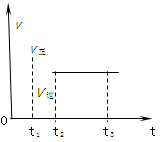
| A.t1时,只有正方向反应 |
| B.t2- t3,各物质的浓度不再发生变化 |
| C.t2- t3,反应不再发生 |
| D.t2时,反应未到达限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为: COCl2(g) CO(g)+Cl2(g) ΔH<0下列有关说法不正确的是
CO(g)+Cl2(g) ΔH<0下列有关说法不正确的是
| A.在一定条件下,使用催化剂能加快反应速率 |
| B.当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变 |
| C.单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态 |
| D.平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于100mL1mol/L盐酸与铁片的反应,采取下列措施:①升高温度;②改用100mL3mol/L盐酸;③多用300mL1mol/L盐酸;④用等量铁粉代替铁片;⑤改用98%的硫酸。其中能使反应速率加快的是( )
| A.①③④ | B.①②④ | C.①②③④ | D.①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com