
A.D3O+ B.Li+ C.OD- D.OH-
科目:高中化学 来源: 题型:
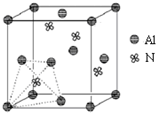 元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:| 700℃ |
| 700℃ |



查看答案和解析>>
科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素 | A | B | C | D |
| 结构性质 信息 |
基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 | 原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有2对成对的p电子 | 其原子序数比A、B、C三种元素原子的质子数总和还少1,有+1、+2两种常见化合价 |
| A-O | A=O | F-O | F=O | |
| 键能(KJ/mol) | 360 | 803 | 464 | 640 |
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.

查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省抚顺市六校联合体高三上学期期中考试化学试卷(解析版) 题型:填空题
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质。回答下列问题(相关回答均用元素符号或化学式表示):
(1)R的基态原子的核外电子排布式是_______。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是________。
(3)X与Z中电负性较大的是__________;Z的某种含氧酸盐常用于实验室中X的单质的制取,此酸根离子的空间构型是_____,此离子中含有的化学键类型是____;X一Z一X的键角_____109. 50。(填“>”、“=”或“<”)
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为_______,以相距一个X离子最近的所有Y离子为顶点构成的几何体为 。该化合物与MgO相比,熔点较高的是_____。

(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为____g/cm3。(列算式,不必计算出数值,阿伏加德罗常数的数值为NA)
查看答案和解析>>
科目:高中化学 来源:2015届福建霞浦一中高一下学期第一次月考化学试卷(解析版) 题型:填空题
A、B、C、D、E五种短周期主族元素,原子序数依次增大。A原子的核外电子数等于最外层电子数;B原子的最外层电子数是次外层电子数的2倍;C原子的M层电子数与L层电子数相差7;D原子的最外层电子数是A、B、C三原子的最外层电子数之和。回答下列问题。
(1)元素B在周期表中的位置为第 周期 族;元素D简单离子的结构示意图为 。
(2)元素C、D简单离子的半径由大到小的顺序为(用离子符号表示) 。
(3)元素B可形成离子BH3-,下列与其具有相同电子数和质子数的微粒是 。
A.NH4+ B.OH- C.F- D.HS-
(4)元素A、C组成化合物甲CA,甲能与水反应产生一种强碱和一种气体,该反应的化学方程式为 。
(5)A元素有aA、a+1A、a+2A三种同位素,E元素有eE、e+2E两种同位素,二者所形成分子的相对分子质量有 种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com