
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含____________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含______________所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 |
方案1 |
|
|
方案2 |
|
|
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1—2滴溴水,溶液呈黄色所发生的离子反应方程式为____________________________________________。
②在100 mL FeBr2溶液中通入2.24 LCl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为____________。
Ⅱ.某校化学实验兴趣小组为“证明某水煤气中CO2、CO、H2、H2O(气)共同存在”。经讨论从以下提供的仪器和药品中设计组合成一套装置(假设其他杂质气体对本实验无干扰)
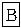
(1)该小组证明CO2存在应选用____________装置,现象是:_______________________。证明H2O(气)的存在应选用_____________装置,现象是______________________________。
(2)若某些仪器可重复使用,某些仪器可不使用,B中反应完全进行,连接的玻璃导管、胶管忽略。按气流从左到右,用上述字母把各装置连接组合起来,正确的连接次序是:混合气体—( )—( )—( B)—( )—( )—( )。
(3)此实验的操作步骤中还有一欠缺之处,应如何改进?
Ⅰ.(2)①Br2 ②Fe3+ (3)d 溶液呈血红色 b CCl4层呈无色,(4)①2Fe2++Br2====2Fe3++2Br- ②1.2 mol/L
Ⅱ.(1)C (石灰水)变混浊 F (无水硫酸铜)由白色变蓝色
(2)混和气体→F—C—![]() →A→F→C
→A→F→C
(3)尾气中可能含CO而没有处理,将尾气通过导管引出用酒精灯火焰将CO烧掉。
解析:Ⅰ.(2)氧化性Fe3+>Br2时,反应2Fe2++Br2====2Fe3++2Br-不能发生,导致溶液呈黄色的微粒仅有Br2。氧化性Fe3+<Br2时,反应2Fe2++Br2====2Fe3++2Br-能够发生,导致溶液呈黄色的微粒仅有Fe3+。(3)证明乙同学的观点是否正确,可检验是否生成了Fe3+,所用试剂为KSCN溶液,预期现象为溶液变成血红色,也可检验Br2是否已反应掉,所用试剂为CCl4,预期现象为CCl4层呈无色。(4)①2Fe2++Br2====2Fe3++2Br-。②![]() 的Br-被氧化时Fe2+已全部反应,产物为FeCl3、Br2、FeBr3,且产物中Br2和FeBr3为3∶4的关系,据此可得配平了的化学方程式为18FeBr2+15Cl2====10FeCl3+6Br2+8FeBr3,n(FeBr2)=
的Br-被氧化时Fe2+已全部反应,产物为FeCl3、Br2、FeBr3,且产物中Br2和FeBr3为3∶4的关系,据此可得配平了的化学方程式为18FeBr2+15Cl2====10FeCl3+6Br2+8FeBr3,n(FeBr2)=![]() n(Cl2)=
n(Cl2)=![]() ×
× ![]() =0.12 mol,c(FeBr2)=
=0.12 mol,c(FeBr2)=![]() =1.2 mol·L-1。
=1.2 mol·L-1。
Ⅱ.(1)证明CO2应选用盛有饱和石灰水的C装置,预期现象是澄清石灰水变浑浊。存在H2O(气)应选用F装置,预期现象是CuSO4由白色变蓝色。(2)为保证结论的可靠,应注意检验顺序和干扰的排除。(3)本实验的尾气含有有毒的CO和易爆的H2,应用导管将尾气导至燃着的酒精灯火焰,使之转化为无毒和不易爆炸的物质。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 某校化学实验兴趣小组为“证明某水煤气中CO2、CO、H2、H2O(气)共同存在”.经讨论从如下图所示提供的仪器和药品中设计组合成一套装置(假设其他杂质气体对本实验无干扰).
某校化学实验兴趣小组为“证明某水煤气中CO2、CO、H2、H2O(气)共同存在”.经讨论从如下图所示提供的仪器和药品中设计组合成一套装置(假设其他杂质气体对本实验无干扰).查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现在足量的稀氯化亚铁溶液中加入1~2滴溴水,振荡后溶液呈黄色.
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现在足量的稀氯化亚铁溶液中加入1~2滴溴水,振荡后溶液呈黄色.| 编号 | 选用试剂 | 实验现象 |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com