
【题目】科学家已经合成出氧的一种单质O4 , 下列关于该物质的说法正确的是( )
A.摩尔质量是64g
B.是氧的一种同位素
C.分子中含有离子键
D.是氧的一种同素异形体
科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是 ( )
2Z(g)一定达到化学平衡状态的是 ( )
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成nmol Z,同时生成2nmol Y
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个盛有催化剂的容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2(g)+3H2(g)![]() 2NH3(g),已知加入1mol N2和4mol H2时,达到平衡后生成amol NH3,在相同温度、压强下,保持平衡时各组分的体积分数不变,对①~③的状态,填写表中空白。
2NH3(g),已知加入1mol N2和4mol H2时,达到平衡后生成amol NH3,在相同温度、压强下,保持平衡时各组分的体积分数不变,对①~③的状态,填写表中空白。
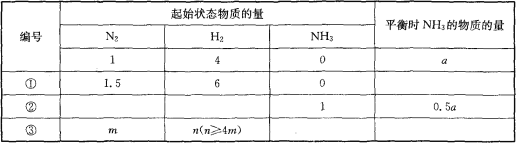
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),平衡时 X、Y、Z 的浓度分别为 0.1 mol / L、0.3 mol /L、0.08mol/L, 则下列判断正确的( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),平衡时 X、Y、Z 的浓度分别为 0.1 mol / L、0.3 mol /L、0.08mol/L, 则下列判断正确的( )
A.c1:c2=3:1
B.平衡时.Y和Z的生成速率之比为2:3
C.X、Y的转化率不相等
D.c1的取值范围为0mol/L<c1<0.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是
A. H2SO4和HNO3都属于酸 B. K2CO3和K2O都属于盐
C. KOH和Na2CO3都属于碱 D. Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究重点。 已知利用FeO与Fe3O4循环制氢的相关反应如下:
反应I. H2O(g)+3FeO(s) ![]() Fe3O4 (s) + H2(g) △H=a kJ mo1-1;
Fe3O4 (s) + H2(g) △H=a kJ mo1-1;
反应II 2 Fe3O4(s) ![]() FeO (s) + O2(g) △H=b kJ mo1-1。
FeO (s) + O2(g) △H=b kJ mo1-1。
(1) 反应:2H2O(g)=2H2(g)+O2(g) △H =________(用含 a、b的代数式表示)kJ mo1-1。
(2)上述反应中a<0、b>0,从能源利用及成本的角度考虑,实现反应II可采用的方案是________。
(3)900℃时,在甲、乙两个体积均为2.0 L的密闭容器中分别投入0.60 mol FeO(s)并通入0.20 mol H2O(g),甲容器用 FeO细颗粒,乙容器用FeO粗颗粒。反应过程中H2的生成速率的变化如图1所示。
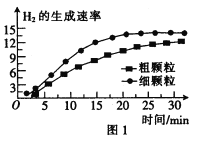
①用FeO细颗粒和FeO粗颗粒时,H2的生成速率不同的原因是__________。.
②用FeO细颗粒时H2O(g)的平衡转化率与用FeO粗颗粒时H2O(g)的平衡转化率的关系是___________(填“前者大”“前者小”或“相等”)。
(4)FeO的平衡转化率与温度的关系如图2所示。请在图3中画出1000℃、用FeO细颗粒时,H2O(g)转化率随时间的变化曲线(进行相应的标注)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.增加反应物浓度可以增加单位体积活化分子数目,但活化分子百分数保持不变
B.升高温度可以提高活化分子的百分数,从而提高反应速率
C.对于任何反应,压缩容器容积来增大压强,反应速率都加快
D.催化剂可以降低反应所需要的活化能,提高活化分子的百分数,从而提高反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.常温下,C(s)+CO2(g) = 2CO(g)不能自发进行,则该反应的△H>0
C.任何能使熵值增大的过程都能自发进行
D.反应物和生成物所具有的总焓决定了反应是否能自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com